Phát biểu nào sau đây không đúng?
Áp dụng lí thuyết về lớp và các phân lớp: các electron trên cùng một phân lớp có năng lượng bằng nhau chứ không khác nhau do đó đáp án “Các electron trên cùng một phân lớp có năng lượng khác nhau” => sai
Phát biểu nào sau đây không đúng?
Áp dụng lí thuyết về lớp và các phân lớp: các electron trên cùng một phân lớp có năng lượng bằng nhau chứ không khác nhau do đó đáp án “Các electron trên cùng một phân lớp có năng lượng khác nhau” => sai
Lớp M có các phân lớp được kí hiệu lần lượt là
Lớp M (n = 3), có 3 phân lớp, được kí hiệu là 3s, 3p, 3d.
Cho nguyên tử K có Z = 19. Cấu hình electron của nguyên tử K là
Nguyên tử K có: số e = số p = Z = 19.
Thứ tự mức năng lượng: 1s22s22p63s23p64s1.
→ Cấu hình electron của K: 1s22s22p63s23p64s1
Phát biểu nào sau đây là đúng?
Electron trong cùng một phân lớp có năng lượng bằng nhau.
Electron trong cùng một lớp có năng lượng bằng nhau sai vì: Electron trong cùng một lớp có năng lượng gần bằng nhau.
Electron ở các phân lớp 1s; 2s; 3s có năng lượng bằng nhau sai vì: Electron ở các phân lớp 1s; 2s; 3s có năng lượng khác nhau.
Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong sai vì: Electron ở lớp bên ngoài có năng lượng cao hơn electron ở lớp bên trong.
Số phân lớp bão hòa trong các phân lớp: 1s2; 2s2; 2p3; 3d10; 3p4 là
Phân lớp bão hòa là phân lớp đã chứa tối đa electron.
Các phân lớp bão hòa là: 1s2; 2s2; 3d10
Nguyên tố sulfur nằm ở ô thứ 16 trong bảng hệ thống tuần hoàn. Biết rằng các electron của nguyên tử sulfur được phân bó trên 3 lớp electron (K, L, M). Số electron ở lớp L trong nguyên tử sulfur là:
Viết cấu hình e: 1s22s22p63s23p4.
Ô nguyên tố thứ 16 ⇒ Z = 16.
Mà số e ở các lớp 1, 2, 3 là: 2/8/8. Mà Z = 16 nên số e của các lớp X là: 2/8/6.
Số e ở lớp L (n = 2) là: 8.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là:
Nguyên tử nguyên tố X có 4 electron ở lớp L
X có 2 electron ở phân lớp 2s và 2 electron ở phân lớp 2p
Cấu hình electron của X là 1s22s22p2
Z = 6
Cho các cấu hình electron của một số nguyên tử nguyên tố như sau:
(1) 1s22s22p5
(2) 1s22s22p63s1
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
(5) 1s22s22p63s23p4
(6) 1s22s22p63s23p3
Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
Các nguyên tố kim loại là:
(2) 1s22s22p63s1
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
Cấu hình electron của nguyên tử sulfur (Z= 16) ở trạng thái cơ bản là
Nguyên tử có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4
Cho các phát biểu sau
(1) Số lượng orbital trong các phân lớp 1s, 2s, 3s là bằng nhau.
(2) Số lượng orbital trong các phân lớp 3s, 3p, 3d là bằng nhau.
(3) Các electron trên các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
(4) Các electron trên các phân lớp 3s, 3p, 3d có năng lượng bằng nhau.
(5) Số lượng electron tối đa trong một lớp là 2n2.
(6) Số lượng các orbital trong một phân lớp (s, p, d, f) luôn là một số lẻ.
Số phát biểu đúng là:
Các phát biểu (1); (5); (6) đúng.
Phát biểu (2) sai vì: Số lượng orbital trong các phân lớp 3s, 3p, 3d là khác nhau.
Phát biểu (3) sai vì: Các electron trên các phân lớp 1s, 2s, 3s có năng lượng khác nhau.
Phát biểu (4) sai vì: Các electron trên các phân lớp 3s, 3p, 3d có năng lượng gần bằng nhau.
Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
Xcó Z = 17 nên nguyên tử X có 17 electron.
⇒ Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5.
⇒ Electron lớp ngoài cùng của X thuộc lớp thứ 3 (lớp M).
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
Cách biểu diễn electron trong AO nào sau đây không tuân theo nguyên lí Pauli?
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
Số lượng AO trong các phân lớp ns; np; nd; nf lần lượt là
Số lượng AO trong mỗi phân lớp
Phân lớp ns có 1 AO;
Phân lớp np có 3 AO;
Phân lớp nd có 5 AO;
Phân lớp ns có 7 AO;
Phát biểu nào sau đây đúng?
Các nguyên tử của nguyên tố khí hiếm đều có 8 electron lớp ngoài cùng => Sai vì He là cũng khí hiếm và chỉ có 2 electron lớp ngoài cùng
Các nguyên tố mà nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là kim loại => Sai vì phải trừ H, Be và B có 1, 2, 3 electron lớp ngoài nhưng không phải kim loại.
Các nguyên tố mà nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng đều là phi kim => Sai vì các nguyên tố mà nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng thường là phi kim.
Phân lớp 3d có nhiều nhất
Phân lớp 3d có nhiều nhất: 2.5 = 10 e
Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây?
Sự phân bố electron trong một orbital dựa vào nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là:
Cấu hình electron của potassium là 1s22s22p63s23p64s1 có thể được biểu diễn theo ô orbital như sau:
| 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 4s1 |
⇒ Potassium có 10 orbital chứa electron.
Nguyên tử F có Z = 9. Số electron độc thân trong nguyên tử F là
Cấu hình electron nguyên tử của F là:
1s22s22p5
Cấu hình theo ô orbital của F là:
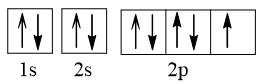
Như vậy nguyên tử F có 1 electron độc thân thuộc AO 2p.
Cho 3 ion: Na+, Mg2+, F-. Câu nào sau đây sai?
Nhận thấy 3 ion Na+, Mg2+, F- có số proton lần lượt là 11, 12, 9. Vậy nhận định “3 ion trên có số hạt proton bằng nhau” là sai.
