Alkane
I. Khái niệm và danh pháp
1. Khái niệm
Alkane là các hydrocabon mạch hở, trong phân tử chỉ có liên kết đơn.
Công thức chung của alkane: CnH2n+2 (với n ![]() 1).
1).
Ví dụ: CH4; C2H6; C3H8; C4H10; C5H12; ...
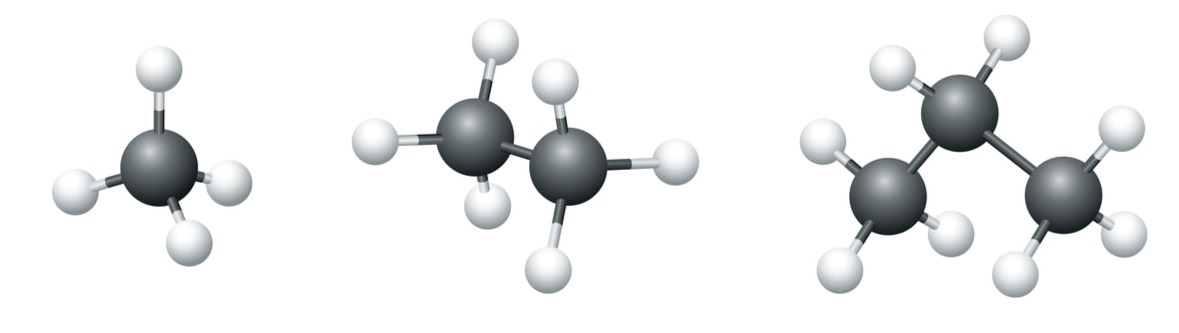
Mô hình phân tử của methane, ethane và propane
Mỗi nguyên tử carbon trong phân tử alkane nằm ở tâm một hình tứ diện, liên kết với bốn nguyên tử (hay nhóm nguyên tử) nằm ở bốn đỉnh của hình tứ diện đó.
2. Đồng phân
Các alkane có từ bốn C trở lên có đồng phân về mạch carbon.
Ví dụ:
- Alkane mạch không phân nhánh:
![]()
- Alkane mạch phân nhánh:
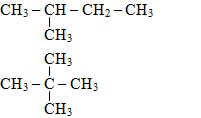
3. Danh pháp
Theo danh pháp thay thế tên của alkane gồm 2 phần: phần đầu (tiền tố) liên quan đến số lượng nguyên tử carbon trong mạch carbon của alkane; phần sau (hậu tố) là -ane với ý nghĩa chỉ hydrocarbon no.
- Tên 10 alkane mạch không phân nhánh đầu tiên trong dãy đồng đẳng cho biết số lượng nguyên tử carbon trong mạch.
| Số nguyên tử carbon | Công thức cấu tạo | Tên gọi | Phần tiền tố |
| 1 | CH4 | methane | meth- |
| 2 | CH3CH3 | ethane | eth- |
| 3 | CH3CH2CH3 | propane | prop- |
| 4 | CH3CH2CH2CH3 | butane | but- |
| 5 | CH3CH2CH2CH2CH3 | pentane | pent- |
| 6 | CH3CH2CH2CH2CH2CH3 | hexane | hex- |
| 7 | CH3CH2CH2CH2CH2CH2CH3 | heptane | hept- |
| 8 | CH3CH2CH2CH2CH2CH2CH2CH3 | octane | oct- |
| 9 | CH3CH2CH2CH2CH2CH2CH2CH2CH3 | nonane | non- |
| 10 | CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 | decane | dec |
Chú ý: Phần tiền tố cho biết số lượng nguyên tử carbon cũng được sử dụng chung cho các loại hợp chất hữu cơ khác có cùng số lượng nguyên tử carbon
- Với alkane mạch phân nhánh:
- Mạch carbon dài nhất là mạch chính, các mạch carbon còn lại là mạch nhánh. Mạch nhánh còn được xem là nhóm thế alkyl của mạch chính.
- Đánh số các nguyên tử carbon trên mạch chính xuất phát từ đầu gần mạch nhánh nhất để tổng số chỉ vị trí của các nhánh là nhỏ nhất.
Khi đó, tên gọi của alkane mạch phân nhánh được gọi như sau:

- Vị trí của nhóm thế alkyl là vị trí của nguyên tử carbon trong mạch chính liên kết với nhóm thế đó.
- Tên nhóm thế alkyl được hình thành bằng cách thêm -yl vào sau phần tiền tố chỉ số nguyên tử carbon có trong nhóm thế.
- Nếu có nhiều nhóm thế giống nhau thì thêm "di" (2 nhóm thế), "tri" (3 nhóm thế), "tetra" (4 nhóm thế),... vào trước tên gọi của nhóm thế.
Ví dụ:
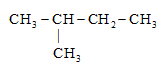
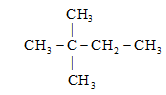
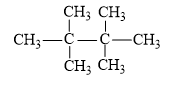
2-methylbutane 2,2-dimethylbutane 2,2,3,3-tetramethylbutane
- Một số tên riêng của alkane:
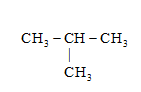
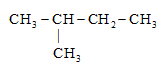
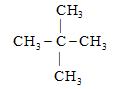
isobutane isopentane neopentane
II. Tính chất vật lí
- Ở điều kiện thường, các alkane từ C1 đến C4 và neopentane ở thể khí. Các alkane có nhiều nguyên tử carbon hơn ở thể lỏng hoặc rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng nhìn chung đều tăng theo khối lượng phân tử của chúng
- Các alkane đều nhẹ hơn nước.
- Do các phân tử alkane kém phân cực nên kém tan trong nước nhưng tan tốt trong các dung môi không phân cực.
III. Tính chất hóa học
Trong phân tử alkane chỉ có các liên kết σ bền và kém phân cực. Mỗi nguyên tử carbon cũng như hydrogen đã tạo ra số liên kết cộng hóa trị lớn nhất của chúng. Vì thế, các alkane khó tham gia phản ứng hóa học và các phản ứng xảy ra sẽ kèm theo việc thay thế nguyên tử hydrogen hoặc bẻ gãy mạch carbon.
1. Phản ứng thế halogen
- Điều kiện phản ứng: chiếu sáng hoặc đun nóng
- Sản phẩm: dẫn xuất halogen như monohalogeno, dihalogeno, trihalogeno,...
Ví dụ:
CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
chloromethane
CH3Cl + Cl2 ![]() CH2Cl2 + HCl
CH2Cl2 + HCl
dichloromethane
CH2Cl2 + Cl2 ![]() CHCl3 + HCl
CHCl3 + HCl
trichloromethane (chloroform)
CHCl3 + Cl2 ![]() ClCl4 + HCl
ClCl4 + HCl
tetrachloromethane (carbon tetrachloride)
Trong phản ứng thế halogen, nguyên tử H ở carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử H ở carbon bậc thấp.
Ví dụ:
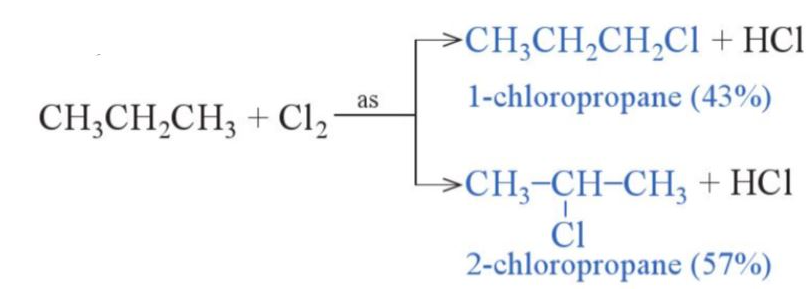
2. Phản ứng craking và phản ứng reforming
- Cracking alkane: là quá trình phân cắt liên kết C-C (bẻ gãy mạch carbon) của các phân tử alkane mạch dài thành những hợp chất có mạch carbon ngắn hơn.
Ví dụ:
![]()
- Phản ứng reforming: là quá trình biến đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
Ví dụ:
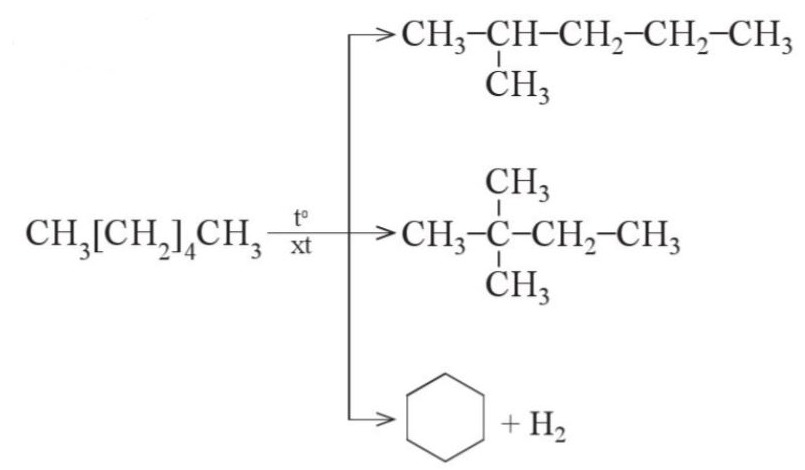
3. Phản ứng oxi hóa
Ở nhiệt độ cao, các alkane bị oxi hóa bởi oxygen.
- Phản ứng oxi hóa hoàn toàn (phản ứng cháy):
![]()
Ví dụ:
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(g)
CO2(g) + 2H2O(g) ![]() = -890 kJ/mol
= -890 kJ/mol
C3H8(g) + 5O2(g) ![]() 3O2(g) + 4H2O(g)
3O2(g) + 4H2O(g) ![]() = -2216 kJ/mol
= -2216 kJ/mol
Các phản ứng này đều tỏa nhiệt nên alkane thường được sử dụng là nhiên liệu trong công nghiệp và trong đời sống.
- Phản ứng oxi hóa không hoàn toàn: tạo thành carbon monoxide hoặc carbon.
IV. Nguồn alkane trong tự nhiên, ứng dụng của alkane
1. Nguồn alkane trong tự nhiên - Điều chế alkane trong công nghiệp
- Alkane dùng trong công nghiệp được lấy từ alkane có trong tự nhiên.
- Methane là thành phần chủ yếu của khí thiên nhiên và cũng được sinh ra trong một số quá trình phân hủy sinh học.
- Các alkane có nhiều trong thành phần của dầu mỏ, khí thiên nhiên và khí dầu mỏ.
2. Ứng dụng
Một số ứng dụng của alkane:




- Dùng làm nhiên liệu.
- Dùng làm nguyên liệu tổng hợp hữu cơ.
- Dùng làm dung môi.
3. Nhiên liệu và môi trường
Khí thải do các phương tiện giao thông hoạt động thải ra trong quá trình đốt cháy nhiên liệu là hỗn hợp của các khí và các hạt khác nhau.
Khói thải và các hạt bụi mịn thải vào khí quyển là tác nhân gây ảnh hưởng nghiêm trọng đến sức khoẻ người dân.

Nguồn ô nhiễm do các phương tiện giao thông
Một số biện pháp hạn chế ô nhiễm không khí:
- Tăng cường hình thức vận tải công cộng.
- Giảm thiểu sự phụ thuộc nhiên liệu hoá thạch, tăng cường các nguồn nhiên liệu xanh, sạch như hydrogen, năng lượng mặt trời.
- Bảo vệ rừng.







