Phenol
I. Khái niệm
1. Khái niệm
Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Phenol đơn giản nhất có công thức cấu tạo thu gọn là C6H5OH có tên là phenol.
| Công thức cấu tạo của phenol |
Mô hình phân tử phenol |
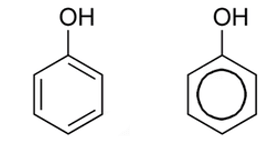 |
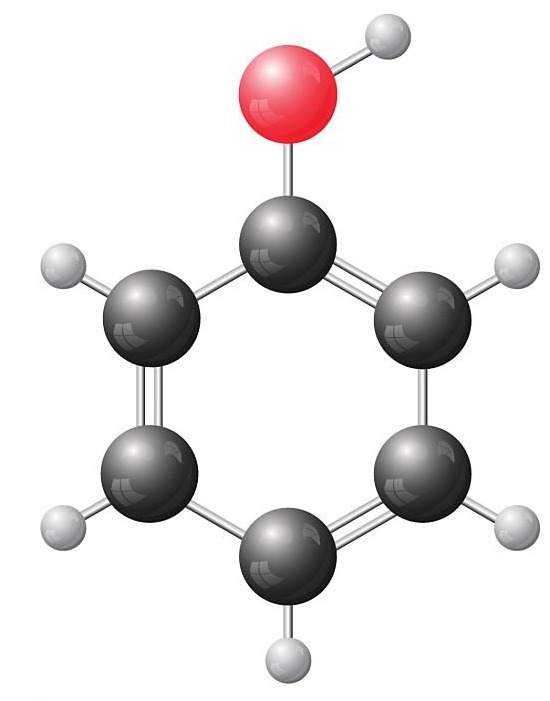 |
2. Phân loại
- Monophenol: là những phenol trong phân tử chứa một nhóm -OH.
Ví dụ: phenol, o-cresol, m-cresol, p-cresol
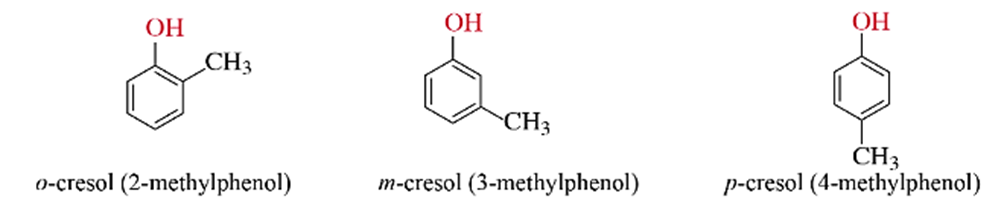
- Polyphenol: là những phenol trong phân tử chứa nhiều nhóm -OH.
Ví dụ:
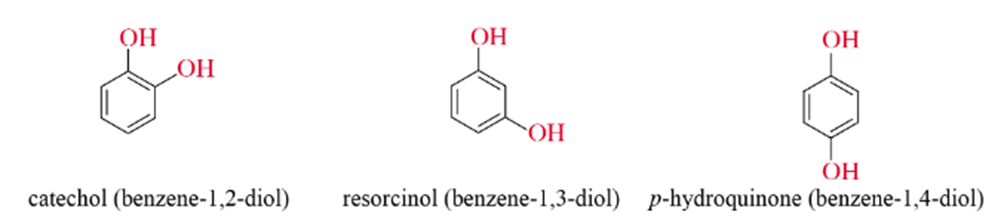
Chú ý: Trong những trường hợp sau này, nếu không nói gì thêm, thì coi “phenol” là chất cụ thể C6H5OH.
II. Tính chất vật lí
 Phenol tinh khiết
Phenol tinh khiết
- Ở điều kiện thường, phenol là chất rắn, không màu, nóng chảy ở 43oC. Phenol dễ bị chảy rữa khi để trong không khí
- Phenol có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các aryl halide có phân tử khối tương đương do tạo được liên kết hydrogen giữa các phân tử.
- Phenol ít tan trong nước lạnh, tan vô hạn ở 66oC và tan tốt trong các dung môi hữu cơ.
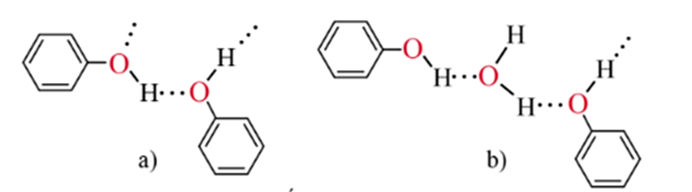
Liên kết hydrogen giữa các phân tử phenol (a)
và giữa phân tử phenol với nước (b)
- Phenol rất độc và gây bỏng khi tiếp xúc với da. Do đó, cần tuyệt đối cẩn thận khi làm thí nghiệm với phenol.
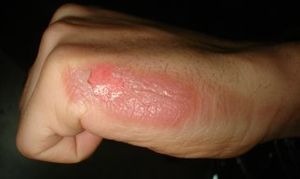
Bàn tay bị bỏng do tiếp xúc với phenol
III. Tính chất hóa học
Trong phân tử phenol, nhóm –OH liên kết trực tiếp với vòng benzene. Nhờ đó, vòng benzene trở thành nhóm hút electron, làm giảm mật độ electron ở nguyên tử oxygen và tăng sự phân cực của liên kết O–H, đồng thời tăng mật độ electron trong vòng benzene.
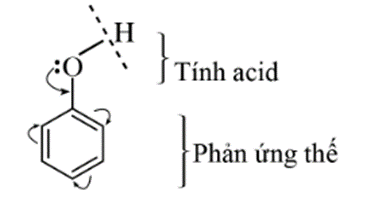
Ảnh hưởng qua lại giữa nhóm -OH và vòng benzene
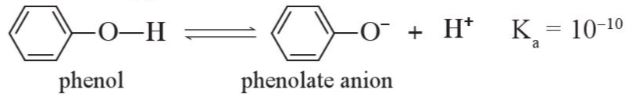
1. Tính acid của phenol
Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím
a) Phản ứng với dung dịch NaOH
C6H5OH + NaOH → C6H5ONa + H2O.
b) Phản ứng với dung dịch sodium carbonate
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
Kết luận: Tính acid của phenol mạnh hơn tính acid của alcohol.
2. Phản ứng thế nguyên tử H của vòng benzene
a) Phản ứng với nước bromine
Nhỏ nước bromine vào dung dịch phenol, thấy xuất hiện kết tủa trắng (2,4,6-tribromophenol).
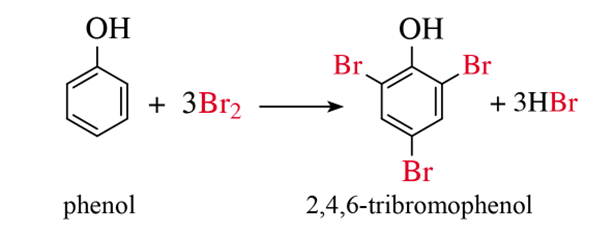 b) Phản ứng với dung dịch HNO3 đặc
b) Phản ứng với dung dịch HNO3 đặc
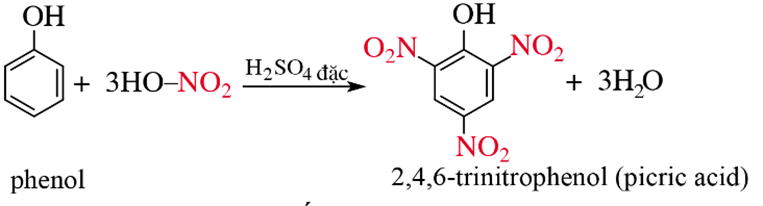
Kết luận: Phản ứng thế nguyên tử H của vòng benzene trong phân tử phenol xảy ra dễ hơn so với benzene.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Phenol là nguyên liệu để sản xuất nhựa epoxy, nhựa phenol-formaldehyde, phẩm nhuộm, thuốc nổ, chất diệt cỏ, diệt nấm mốc…
- Do có tính diệt khuẩn nên phenol được sử dụng làm chất khử trùng, tẩy uế. Thuốc xịt chloraseptic chứa 1,4% phenol được dùng làm thuốc chữa đau họng.
 |
 |
 |
 |
| Một số sản phẩm có phenol trong thành phần | |
2. Điều chế
- Trong công nghiệp, phenol được sản xuất từ cumene theo sơ đồ sau:
![]()
cumene phenol acetone
- Phenol cũng được tách ra từ nhựa than đá trong quá trình luyện cốc.
Nội dung cùng chủ đề
-
Đề kiểm tra Hóa học 11 Cánh Diều
-
Chủ đề 1: Cân bằng hóa học
-
Chủ đề 2: Nitrogen và sulfur
-
Chủ đề 3: Đại cương về hóa học hữu cơ
-
Chủ đề 4: Hydrocarbon
-
Chủ đề 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chủ đề 6: Hợp chất carbonyl - Carboxylic acid







