Dẫn xuất halogen
I. Khái niệm, đồng phân và danh pháp
1. Khái niệm
Khi thay thế nguyên tử hydrogen của phân tử hydrocarbon bằng nguyên tử halogen được dẫn xuất halogen của hydrocarbon (gọi tắt là dẫn xuất halogen).
Ví dụ:
| Hydrocarbon | Dẫn xuất halogen tương ứng |
| CH4 | CH3Cl, CH2Cl2, CH3Cl, CH3Br, CH3I,... |
| CH3-CH3 | CH3CH2Cl, CH2Br-CH2-Br |
| CH2=CH2 | CH2=CH-Cl, CF2=CF2,... |
| C6H6 | C6H5Br, C6Cl6,... |
2. Đồng phân
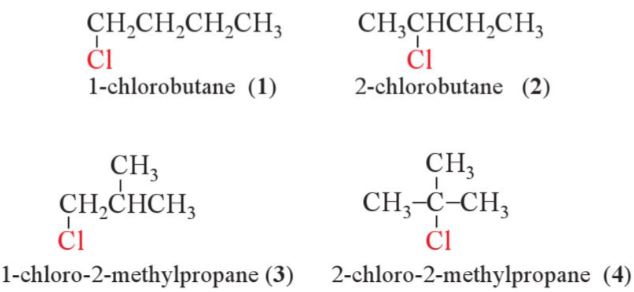
- Dẫn xuất halogen có đồng phân mạch carbon giống như hydrocarbon.
- Ngoài ra, dẫn xuất halogen còn có đồng phân vị trí nhóm chức.
Ví dụ: Các đồng phân halogen của C4H9Cl:
3. Danh pháp
Danh pháp thay thế:
- Chọn mạch chính là mạch dài nhất có chứa nguyên tố halogen.
- Đánh số thứ tự chỉ vị trí nguyên tử carbon trên mạch chính sao cho tổng số chỉ vị trí của các nhóm thế là nhỏ nhất.
- Đối với các dẫn xuất halogen không no, ưu tiên đánh số từ phía đầu mạch gần liên kết bội hơn.
Tên thay thế của dẫn xuất halogen được gọi như sau:

Ví dụ:
Cl2CHCH3 ClCH2CH2Cl CH2=CHCH2Cl
1,2-dichloroethane 1,2-dichloroethane 3-chloroprop-1-ene
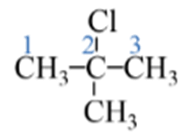
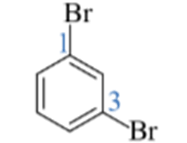
2-chloro-2-methylpropane 1,3-dibromobenzene
Danh pháp thông thường: Một số dẫn xuất halogen được gọi theo tên thông thường.
Ví dụ:
| CHCl3 | CHBr3 | CHI3 |
| chloroform | bromoform | iododorm |
II. Tính chất vật lí
- Ở điều kiện thường, các dẫn xuất halogen có phân tử khối nhỏ ở thể khí (như CH3F, CH3Cl, CH3Br). Các dẫn xuất halogen có phân tử khối lớn hơn thường ở thể lỏng hoặc ở thể rắn như (CH3I, CH2Cl2, CHCl4, CCl4, C6H5Br,...).
- Phần lớn dẫn xuất halogen nặng hơn nước và không tan trong nước, tan tốt trong dung môi hữu cơ kém phân cực như hydrocarbon, ether,…
 |
|
| a) Chloroform | b) Iodoform |
| Một số dẫn xuất halogen | |
III. Tính chất hóa học
Nhờ có sự phân cực của liên kết C – X, dẫn xuất halogen dễ tham gia vào nhiều phản ứng hoá học.
1. Phản ứng thế nguyên tử halogen bằng nhóm –OH
R – X + NaOH ![]() R – OH + NaX
R – OH + NaX
- Với X là các halogen Cl, Br, I
- Phản ứng này được gọi là phản ứng thủy phân dẫn xuất halogen.
Ví dụ:
CH3-Cl + NaOH ![]() CH3-OH + NaCl
CH3-OH + NaCl
2. Phản ứng tách hydrogen halide
Trong phản ứng tách hydrogen halide, nguyên tử halogen tách ra cùng nguyên tử hydrogen bên cạnh để tạo thành alkene. Khi có nhiều alkene có thể được tạo thành thì sản phẩm chính được xác định theo quy tắc Zaitsev.
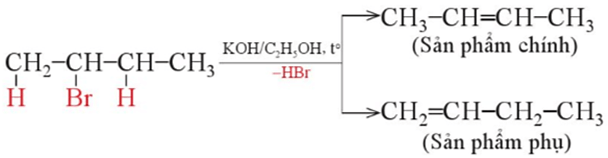
Quy tắc Zaitsev: Trong phản ứng tách hydrogen halide ra khỏi dẫn xuất halogen, ưu tiên tách nguyên tử halogen cùng nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn.
IV. Ứng dụng của dẫn xuất halogen
- Các dẫn xuất halogen như CHCl3, CCl4, CH2Cl2… được dùng làm dung môi trong phòng thí nghiệm và trong công nghiệp.
- Một số dẫn xuất halogen được sử dụng để tổng hợp polimer, alcohol, ether hoặc các hợp chất cơ nguyên tố.
- Trùng hợp CF2=CF2 thu được polytetrafluoroethylene (PTFE) hay teflon được dùng làm chảo chống dính, vật liệu cách điện, các ống chịu hóa chất, bình phản ứng…
 |
 |
 |
| a) Ống nhựa được làm từ PVC | b) Chảo chống dính phủ teflon | c) Đồ lặn được chế tạo từ cao su chloroprene |
| Ứng dụng của một số polymer được sản xuất từ dẫn xuất halogen | ||
- CHCl3, CH3CH2Cl, CF3-CHClBr… được dùng làm chất gây mê trong y học. CH3CH2Cl được dùng làm chất giảm đau tạm thời cho các chấn thương nhỏ trong thể thao. CH3Br là chất khử trùng, tiêu diệt các loài dịch hại như nhện, ve, nấm, côn trùng…
- Các chất 2,4-D và 2,4,5-T ở nồng độ thấp (vài phần triệu) có tác dụng kích thích sự sinh trưởng của thực vật. Tuy nhiên, ở nồng độ cao, chúng có tác dụng diệt cây cỏ, được sử dụng làm chất diệt cỏ, phát quang rừng rậm.
Nội dung cùng chủ đề
-
Đề kiểm tra Hóa học 11 Cánh Diều
-
Chủ đề 1: Cân bằng hóa học
-
Chủ đề 2: Nitrogen và sulfur
-
Chủ đề 3: Đại cương về hóa học hữu cơ
-
Chủ đề 4: Hydrocarbon
-
Chủ đề 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chủ đề 6: Hợp chất carbonyl - Carboxylic acid







