Sulfur và sulfur dioxide
Bài học giới thiệu đến các em lý thuyết bài Sulfur và sulfur dioxide. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 11 Cánh diều.
I. Sulfur
1. Trạng thái tự nhiên
Sulfur: kí hiệu hóa học là S, số hiệu nguyên tử là 16, độ âm điện là 2,58.
Trong tự nhiên: tồn tại ở cả đơn chất và hợp chất.
- Đơn chất: ở vùng có núi lửa như Nhật Bản, Chile, Indonesia, ...
- Hợp chất: khoáng vật, như pyrite (FeS2), sphalerite (ZnS), thạch cao (CaSO4), barite (BaSO4), …
Mẫu khoáng vật sulfur khai thác từ mỏ
2. Tính chất
a) Tính chất vật lí
Ở điều kiện thường:
- Trạng thái: chất rắn.
- Màu sắc: màu vàng.
- Không tan trong nước, ít tan trong ethanol, tan nhiều trong dầu hỏa, benzene.
b) Tính chất hóa học
Ở điều kiện thường, phân tử đơn chất sulfur gồm 8 nguyên tử S (S8).
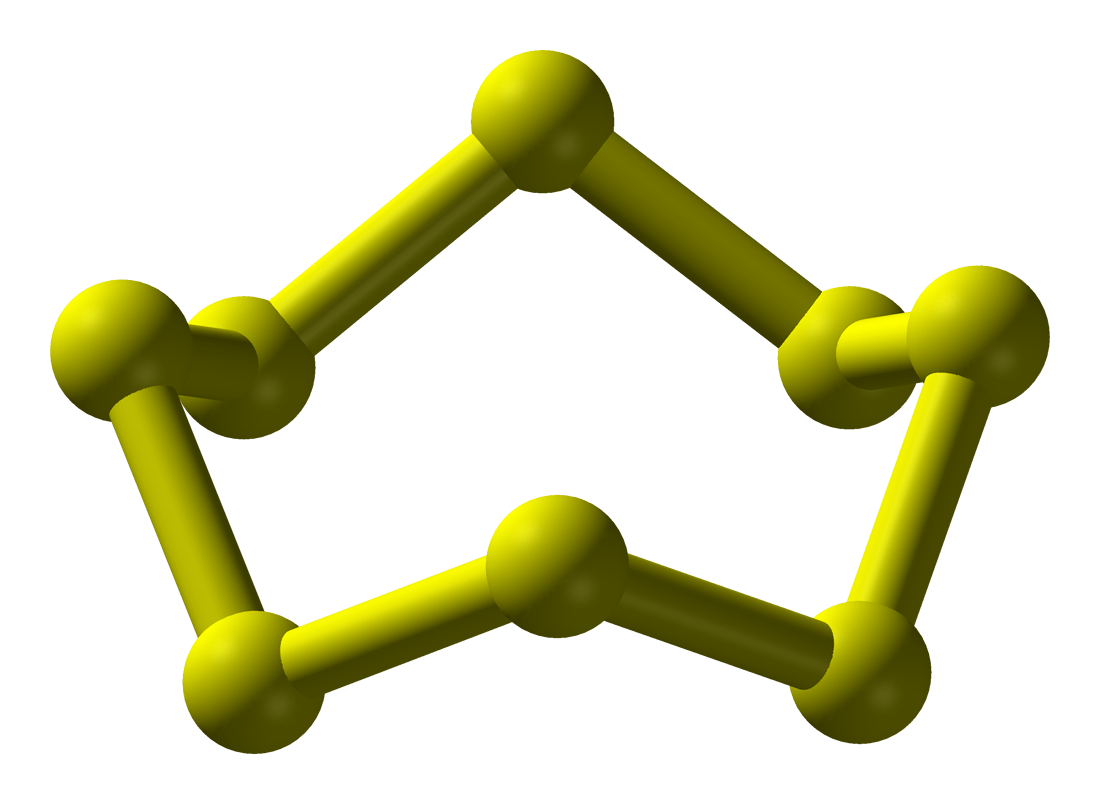
Khi tham gia phản ứng hóa học, sulfur thể hiện tính oxi hóa hoặc tính khử.
Tính oxi hóa:
Phản ứng với với kim loại, hydrogen ở nhiệt độ cao.
Ví dụ:
![]()
Phản ứng với thủy ngân ngay ở nhiệt độ thường:
![]()
Tính khử:
Tác dụng được với một số phi kim, như: oxygen, chlorine, fluorine.
Ví dụ:
![]()
3. Ứng dụng
Sản xuất sulfuric acid, dược phẩm, phẩm nhuộm, thuốc trừ sâu, làm biến đổi tính chất của cao su tự nhiên,…
II. Sulfur dioxide
1. Một số tính chất
Tính chất vật lí: Ở điều kiện thường, SO2 là chất khí không màu, có mùi hắc, độc, tan nhiều trong nước.
Tính chất hóa học:
Thể hiện tính chất acidic acid:
- Phản ứng với nước tạo môi trường acid
- Phản ứng với basic oxide tạo muối.
- Phản ứng với base tạo muối.
Thể hiện cả tính oxi hóa và tính khử:
- Tính oxi hóa:
![]()
- Tính khử:
![]()
2. Ứng dụng
- Là chất trung gian trong quá trình sản xuất sulfuric acid.
- Tẩy trắng vải sợi, đường.
- Sản xuất thuốc trừ sâu, thuốc sát trùng.
- Diệt khuẩn, nấm mốc …
3. Một số biện pháp giảm thải sulfur dioxide vào khí quyển
- Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen, … kết hợp với nguồn năng lượng tái tạo.
- Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải ra môi trường.
- Chuyển hóa sulfur dioxide thành các chất ít gây ô nhiễm hơn như vôi sống, vôi tôi hoặc đá vôi.
Nội dung cùng chủ đề
-
Đề kiểm tra Hóa học 11 Cánh Diều
-
Chủ đề 1: Cân bằng hóa học
-
Chủ đề 2: Nitrogen và sulfur
-
Chủ đề 3: Đại cương về hóa học hữu cơ
-
Chủ đề 4: Hydrocarbon
-
Chủ đề 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chủ đề 6: Hợp chất carbonyl - Carboxylic acid








