Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử N có độ âm điện lớn) với nguyên tử N còn cặp electron hóa trị chưa tham gia liên kết.
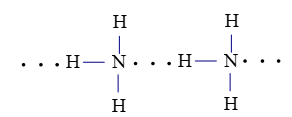
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử N có độ âm điện lớn) với nguyên tử N còn cặp electron hóa trị chưa tham gia liên kết.

X, Y là hai nguyên tố thuộc cùng một nhóm A, ở hai chu kỳ liên tiếp. Cho biết tổng số electron trong anion XY32− là 42. Liên kết giữa X và Y trong ion XY32- thuộc loại liên kết nào?
Tổng số electron: pX + 3pY + 2 = 42
- Nếu pX – pY = 8 ⇒ pX = 16, pY = 8. Ion là SO32-
- Nếu pY – pX = 8 ⇒ pX = 4, pY = 12, loại vì Be và Mg không tạo ion dạng MgBe32-
⇒ Liên kết giữa S và O là liên kết cộng hóa trị phân cực.
Trong một phân tử CO2 có số cặp electron chung là
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
C (Z = 6): [He]2s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ xu hướng nhận 4 electron để đạt cấu hình electron bền vững ⇒ góp 4 electron tạo 4 cặp electron dùng chung với O.
Sự hình thành liên kết cộng hóa trị trong phân tử CO2:
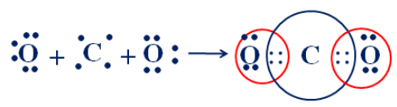
Vậy trong một phân tử CO2 có 4 cặp electron chung.
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
H2, HCl, NH3, F2, HI, CO2, N2, CH4 chỉ chứa liên kết cộng hóa trị.
Vậy chỉ có dãy KCl, Al2O3, NaF, Ba(OH)2 tất cả các phân tử đều có liên kết ion.
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
Phát biểu nào sau đây không đúng?
Hợp chất KNO3 tạo nên bởi ion đơn nguyên tử (K+) và ion đa nguyên tử (NO3-).
K+ + NO3− → KNO3
Dựa vào độ âm điện, so sánh độ phân cực của các phân tử sau: Na2O, NH3, H2S, H2O. Cho biết độ âm điện: Na (0,93), H (2,2); N (3,04); O (3,44); S (2,58)
Ta có:
|
Hợp chất |
Hiệu độ âm điện giữa 2 nguyên tử |
|
Na2O |
O và Na: 3,44 - 0,93 = 2,51 |
|
NH3 |
N và H: 3,04 - 2,2 = 0,84 |
|
H2S |
S và H: 2,58 - 2,2 = 0,38 |
|
H2O |
O và H: 3,44 - 2,2 = 1,24 |
Giá trị hiệu độ âm điện tăng dần như sau: 0,38 < 0,84 < 1,24 < 2,51
Độ phân cực của các phân tử xếp theo thứ tự răng dần: H2S < NH3 < H2O < Na2O.
Trong phân tử N2, mỗi nguyên tử N đã góp 3 electron để tạo cặp electron chung. Nhờ đó mỗi nguyên tử N đã đạt cấu hình electron bền vững của khí hiếm
N (Z = 7): 1s22s22p3 có 5 electron lớp ngoài cùng ⇒ mỗi nguyên tử N góp 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.

Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
∆ =
(Cl) -
(Na) = 3,16 - 0,93 = 2,23 ≥ 1,7
⇒ Liên kết trong phân tử NaCl là liên kết ion.
∆ =
(C) -
(H) = 2,55 - 2,2 = 0,35 < 0,4
⇒ Liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực.
∆ =
(O) -
(H) = 3,44 - 2,2 = 1,24 mà 0,4 < 1,24 < 1,7
⇒ Liên kết trong phân tử H2O là liên kết cộng hóa trị có cực.
∆ =
(Cl) -
(H) = 3,16 - 2,2 = 0,96 mà 0,4 < 0,96 < 1,7
⇒ Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Nguyên tố X và Y thuộc nhóm A; nguyên tử nguyên tố X có 7 electron trên các phân lớp s, nguyên tử nguyên tố Y có 17 electron trên các phân lớp p. Công thức hợp chất tạo bởi X và Y; liên kết hóa học trong hợp chất đó là
Nguyên tử nguyên tố X có 7 electron trên các phân lớp s
⇒ X : 1s22s23s24s25s1
Vì thuộc nhóm A nên X thuộc nhóm IA
nguyên tử nguyên tố Y có 17 electron trên các phân lớp p
⇒ Y : 2p63p64p5 ⇒ 4s24p5
Vì Y thuộc nhóm A ⇒ X thuộc nhóm VIIA
⇒ Hợp chất XY : liên kết ion
Cho các hợp chất sau: NH3, MgO, HCl, K2SO4, H2O. Số hợp chất mà phân tử chứa liên kết ion là
Hợp chất mà phân tử chứa liên kết ion là: MgO, K2SO4.
Cho 4 đơn chất F2, Cl2, Br2, I2. Chất có nhiệt độ sôi cao nhất là
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất. Do đó I2 có nhiệt độ sôi cao nhất.
Anion XY32– có tổng số hạt mang điện là 62. Số hạt mang điện trong hạt nhân của Y nhiều hơn số hạt mang điện trong hạt nhân của X là 2. Nhận định nào sau đây là sai?
Gọi số hạt proton và electron của nguyên tử nguyên tố X là px và ex (px = ex)
Gọi số hạt proton và electron của nguyên tử nguyên tố Y là py và ey (py = ey)
- Anion XY32− có tổng số hạt mang điện là 62 hạt.
⟹ px + ex + 3(py + ey) + 2 = 62
⟺ 2px + 6py = 60 (1)
- Số hạt mang điện trong hạt nhân của Y nhiều hơn số hạt mang điện trong hạt nhân của X là 2 hạt.
⟹ py – px = 2 (2)
Từ (1) và (2) ta có:
Vậy X là C và Y là O.
Z là nguyên tố cùng phân nhóm với Y ở chu kì kế tiếp Z là S.
⟹ Phân tử hợp chất giữa X và Z là CS2
⟹ Tổng số hạt mang điện trong CS2 là: 6 + 6 + 2.(16 +16) = 76
Cho biết năng lượng của một số liên kết ở điều kiện chuẩn (25oC, 1 bar) như sau: S - H (368 kJ/mol); O-H (464 kJ/mol). Tổng năng lượng liên kết trong mỗi phân tử H2S và H2O lần lượt là
Ta có:
H2S: H- S-H
Phân tử H2S chứa 2 liên kết H-S:
⇒ Tổng năng lượng liên kết trong H2S: 2.368 = 736 kJ/mol.
H2O: H - O - H
Phân tử H2O chứa 2 liên kết H-O
⇒ Tổng năng lượng liên kết trong H2O: 2.464 = 928 kJ/mol.
Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các
Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời.

Cation M+ và anion X- đều có cấu hình electron phân lớp ngoài cùng là 3p6. Cho đơn chất M tác dụng với đơn chất X thu được sản phẩm là
Cấu hình electron của cation M+ và anion X-: 1s22s22p63s23p6.
Nguyên tử M nhường 1 electron để tạo thành cation M+:
M → M+ + 1e
Cấu hình electron của nguyên tử M: 1s22s22p63s23p64s1 (Z = 19)
M là kim loại K.
Nguyên tử X nhận 1 electron để trở thành anion X-:
X + 1e → X-
Cấu hình electron của nguyên tử X: 1s22s22p63s23p5 (Z = 17)
X là phi kim Cl.
Cho đơn chất M tác dụng với đơn chất X: 2K + Cl2 2KCl.
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
X thuộc nhóm IA là kim loại điển hình, điện tích 1+.
Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1-.
Công thức hợp chất là XY, liên kết giữa X và Y là liên kết ion.
Tổng số hạt cơ bản của phân tử CaX2 là 288, trong đó tổng số hạt mang điện hơn số hạt không mang điện là 72. Biết số hạt e, p, n của Ca lần lượt là 20, 20, 20 và độ âm điện của Ca, S, Br Cl lần lượt là 1,0; 2,58; 2,96; 3,16. Liên kết hóa học trong CaX2 là
Gọi p, n lần lượt là số hạt proton và số hạt notron trong nguyên tử X, ta có hệ phương trình:
X có Z = 35 nên X là Br
Hiệu độ âm điện giữa 2 nguyên tử Ca và Br là:
CaX2 có liên kết ion.
Phát biểu nào sau đây sai?
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hóa trị).
Nguyên tử X có điện tích hạt nhân là +19. Khi hình thành liên kết hóa học X có xu hướng
Nguyên tử X có điện tích hạt nhân là +19
⇒ ZX = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 elctron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm.
Hợp chất vô cơ T có công thức phân tử XY2. Tổng số các hạt trong phân tử T là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của Y nhiều hơn X là 4. Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt. Trong T chỉ chứa loại liên kết nào?
Gọi tổng số hạt proton, neutron và electron của nguyên tử X là: pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, nơtron và electron của nguyên tử XY2 là 66
Px + nx + ex + 2.(py + ny + ey)= 66 hay 2px + nx + 4py +2ny = 66 (1)
(Vì px = ex và py = ey)
Số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên :
Px + ex + 2py + 2ey – nx - 2ny = 22
hay 2px + 4py - nx - 2ny = 22 (2)
Số khối của Y nhiều hơn X là 4
Px + nx – (py + ny) = 4 (3)
Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt
py + ny + ey – (Px + nx + ex) = 6
hay 2py + ny – (2px + nx) = 6 (4)
Từ (1), (2), (3), (4) ta có:
px = 6 (C) và py = 8 (O).
Công thức cấu tạo của CO2 O=C=O
Vậy phân tử chỉ có liên kết cộng hóa trị.
Phân tử XY3 có tổng số hạt proton, neutron và electron bằng 196. Trong đó hạt mang điện nhiều hơn số hạt không mang điện là 60, số hạt mang điện của X ít hơn số hạt mang điện của Y trong phân tử là 76. Xác định loại liên kết trong phân tử XY3.
Gọi tổng số hạt proton, neutron và electron của nguyên tử X là: pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, neutron và electron của nguyên tử XY3 là 196:
px + nx + ex + 3.(py + ny + ey) = 196
Ta có px = ex và py = ey 2px + nx + 6py + 3ny = 196 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 60 nên:
px + ex + 3py + 3ey – nx – 3ny = 60 2px + 6py - nx - 3ny = 60 (2)
Số hạt mang điện của X ít hơn số hạt mang điện của Y trong phân tử là 76:
px + ex + 76 = 3(py + ey)
6py – 2px = 76 (3)
Lấy (1) + (2) ta có: 4px + 12py = 256 (4)
Giải hệ (3) và (4) ta có: px = 13 (Al), py = 17 (Cl)
Dựa vào độ âm điện Phân tử AlCl3 có chứa liên kết cộng hóa trị phân cực.
Phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Fe3+ và O2- là hợp chất
(a) cộng hóa trị.
(b) ion.
(c) có công thức Fe2O3.
(d) có công thức Fe3O2.
Hợp chất tạo nên bởi ion Fe3+ và O2- là hợp chất ion, có công thức phân tử là Fe2O3.
Nguyên tử Al có Z = 13. Cấu hình electron của ion Al3+ là
Cấu hình electron nguyên tử của Al (Z = 13): 1s22s22p63s23p1.
Nguyên tử Al nhường 3 electron để tạo thành ion Al3+:
Al → Al3+ + 3e.
Cấu hình electron của ion Al3+: 1s22s22p6.
Cho các chất sau. CH4, H2O, HF, BF3, C2H5OH, PCl5. Số chất tạo được liên kết hydrogen là
Điều kiện cần và đủ để tạo thành liên kết hydrogen:
Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,...
Nguyên tử F, O, N,... liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
Số chất tạo liên kết hydrogen là: H2O, HF, C2H5OH.
Tính chất nào không phải của các hợp chất ion?
Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
Liên kết ion trong hợp chất KF được tạo bởi lực hút tĩnh điện giữa
Liên kết ion trong hợp chất KF được tạo bởi lực hút tĩnh điện giữa cation K+ và anion F-.
Cho các ion: K+, Ca2+, Cl-, CO32-. Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là
Các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là: KCl; K2CO3; CaCl2; CaCO3.
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Z = 12: 1s22s22p63s2
Z = 9: 1s22s22p5
Z = 11: 1s22s22p63s1
Z = 10: 1s22s22p6
Ta thấy nguyên tử có Z = 12 thì có 2 electron ở lớp ngoài cùng Có xu hướng nhường 2 electron.
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết:
X thuộc chu kì 4, nhóm IA.
Y thuộc chu kì 2, nhóm VIIA.
X và Y là kim loại điển hình và phim kim điển hình nên liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết ion.
Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
- Tổng số proton trong hợp chất M2X bằng 46.
- Trong hạt nhân của M có n – p = 1, trong hạt nhân của X có n’ = p’.
- Trong hợp chất M2X, nguyên tố X chiếm 8/47 khối lượng phân tử.
Số hạt proton trong hạt nhân nguyên tử M, X và liên kết trong hợp chất M2X lần lượt là
Theo đề bài ta có:
2pM + pX = 46 (1)
nM - pM = 1 và nX = pX
Trong phân tử M2X thì X chiếm 8/47 phần khối lượng nên:
Lại có nM = pM + 1 và nX = pX, thay vào (2) được:
−32pM + 78pX = 16 (3)
Từ (1) và (3) giải được pM = 19; pX = 8
Vậy hợp chất là K2O, có liên kết ion.
Tương tác van der Waals tăng khi
Tương tác van der Waals tăng khi khối lượng phân tử tăng, kích thước phân tử tăng.
Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
Khí hiếm argon (Z = 18): 1s22s22p63s23p6
Fluorine (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ne: 1s22s22p6
Oxygen (Z = 8): 1s22s22p4 có 6 electron lớp ngoài cùng. Xu hướng nhận thêm 2 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ne: 1s22s22p6
Hydrogen (Z = 1): 1s1 có 1 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là He: 1s2
Chlorine (Z = 17): 1s22s22p63s23p5 có 7 electron lớp ngoài cùng. Xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ar: 1s22s22p63s23p6.
Vậy nguyên tử nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học.
Mô tả sự hình thành ion của nguyên tử Mg (Z = 12) theo quy tắc octet là
Mg (Z = 12) có cấu hình electron: 1s22s22p63s2 ⇒ Có 2 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, Mg có xu hướng nhường 2 electron lớp ngoài cùng để trở thành ion mang điện tích dương.
Mg ⟶ Mg2+ + 2e
Phân tử H2 được hình thành từ
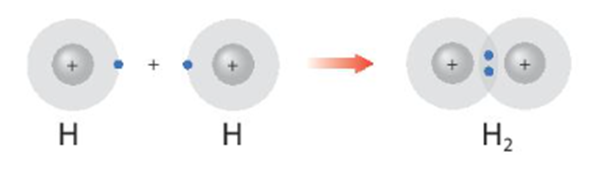
Hydrogen (H) có cấu hình electron là 1s1, hai nguyên tử này liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron để tạo thành cặp electron chung trong phân tử H2. Như vậy, trong phân tử H2, mỗi phân tử có 2 electron đạt cấu hình bền vững của khí hiếm.
Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là?
Cl2: Liên kết (Cl-Cl) là liên kết cộng hóa trị không cực
HCl: Liên kết (H-Cl) là liên kết cộng hóa trị phân cực
NaCl: Liên kết (Na-Cl) là liên kết ion
Ta có sự tăng dần liên kết trong phân tử là: Cl2, HCl, NaCl.
Công thức của hợp chất ion được hình thành từ anion Y− và cation X2+ là
Tổng điện tích của các ion trong hợp chất ion bằng 0.
Giả sử công thức có dạng: XaYb
a.(+2) + b.(-1) = 0
Công thức của hợp chất là XY2
Hợp chất có chứa liên kết ion là
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình Hợp chất chứa liên kết ion là BaCl2.
Liên kết ion được hình thành bởi
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Tổng số hạt của nguyên tử X là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Để đạt được quy tắc octet, nguyên tử X phải nhường hay nhận đi
Đặt số p = số e = Z; số n = N
Ta có tổng số hạt của nguyên tử X là 34: 2Z + N = 34 (1)
Số hạt mạng điện nhiều hơn số hạt không mang điện là 10: 2Z – N = 10 (2)
Giải hệ phương trình (1) và (2) thu được Z = 11 và N = 12
Ta có thể tìm ra được X là Na (Z = 11)
Cấu hình electron của nguyên tử Na là: 1s22s22p63s1 ⇒ Có 1 electron lớp ngoài cùng
Do đó, nguyên tử Na phải nhường đi 1 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
