X+, Y2+ có cùng cấu hình electron của nguyên tử argon (Z = 18) và T có số hiệu nguyên tử là 12. Phát biểu nào sau đây đúng khi nói về X, Y, T?
Hướng dẫn:
Cấu hình electron của Ar: 1s22s22p63s23p6
Cấu hình electron của X: 1s22s22p63s23p64s1 (X+ + 1e thành X): ô 19, chu kì 4, nhóm IA
Cấu hình electron của Y: 1s22s22p63s23p64s2 (Y2+ + 2e thành Y): ô 20, chu kì 4, nhóm IIA
Cấu hình electron của T: 1s22s22p63s2: ô 12, chu kì 3, nhóm IIA
⇒ X và Y thuộc cùng một chu kì.
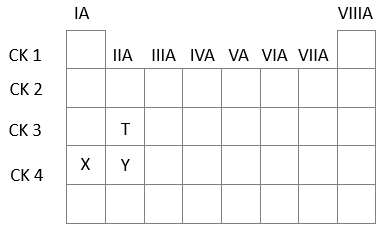
-Trong một chu kì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là X > Y.
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử tăng dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là Y > T
⇒ Chiều giảm dần bán kính nguyên tử là X > Y > T.
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần ⇒ Thứ tự giảm dần về tính kim loại là X > Y
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần ⇒ Thứ tự giảm dần về tính kim loại là Y > T
⇒ Chiều giảm dần tính kim loại là X > Y > T.
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, độ âm điện tăng dần ⇒ Thứ tự giảm dần về độ âm điện là Y > X
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, độ âm điện giảm dần ⇒ Thứ tự giảm dần về độ âm điện là T > Y
⇒ Thứ tự giảm dần độ âm điện là T > Y > X.











