Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài học: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học đã giới thiệu cho các em lý thuyết về các yếu tố ảnh hưởng và ý nghĩa thực tiễn của tốc độ phản ứng hóa học. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Chân trời sáng tạo
I. Ảnh hưởng của nồng độ
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
Giải thích: Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
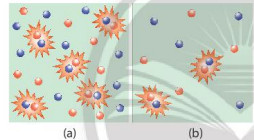
Hình 1. Hình minh hoạ chất phản ứng có nồng độ lớn (a) và nồng độ bé (b)
II. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, tốc độ phản ứng tăng.
Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ, khi tăng nhiệt độ, các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
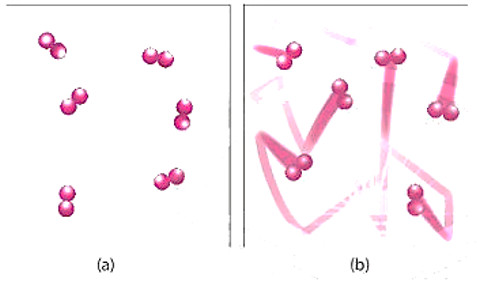
Hình 2. Hình minh hoạ chuyển động của chất phản ứng khi chưa đun nóng (a) và được đun nóng (b)
Kết quả từ các thực nghiệm cho biết, khi nhiệt độ tăng lên 10°C, tốc độ của phần lớn các phản ứng tăng từ 2 đến 4 lần. Số lần tăng này được gọi là hệ số nhiệt độ Van't Hoff (Van-hop), kí hiệu là ![]() .
.
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức:
![]()
Trong đó:
vt1, vt2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2
![]() là hệ số nhiệt độ Van't Hoff.
là hệ số nhiệt độ Van't Hoff.
Lưu ý: Quy tắc Vant Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
III. Ảnh hưởng của áp suất
Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
Giải thích: Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.
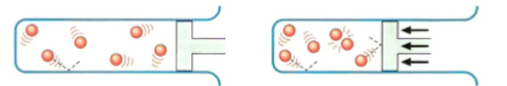
Áp suất thường Áp suất cao hơn
Hình 3: Minh họa khi tăng áp suất của các chất khí tham gia phản ứng
IV. Ảnh hưởng của bề mặt tiếp xúc
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
Giải thích: Khi tăng diện tích tiếp xúc của chất phản ứng, số va chạm hiệu quả tăng dẫn đến tốc độ phản ứng tăng.
Ví dụ: Thực hiện các thí nghiệm sau:
- Thí nghiệm 1: Cho 2 gam CaCO3 dạng khối tác dụng với 20 ml HCl 1M.
- Thí nghiệm 2: Cho 2 gam CaCO3 dạng bột tác dụng với 20 ml HCl 1M.
Kết quả: Ở thí nghiệm 2 phản ứng diễn ra nhanh hơn.
Giải thích: Khi HCl phản ứng với CaCO3 dạng bột, diện tích tiếp xúc giữa các phân tử HCl và CaCO3 tăng lên ⇒ số va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
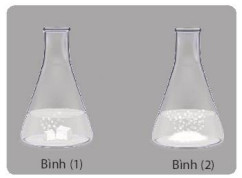
Hình 4. Minh hoạ thí nghiệm nghiên cứu ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
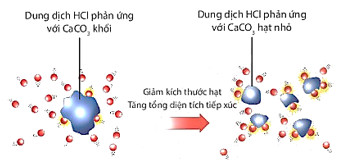
Hình 5. Minh hoạ dung dịch HCl phản ứng với CaCO3 có kích thước khác nhau
V. Ảnh hưởng của chất xúc tác
Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
Với một số phản ứng hoá học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác được ghi trên mũi tên trong phương trình hoá học.
Ví dụ: Phương trình hóa học của phản ứng:
C2H5OH + CH3COOH ![]() CH3HCOOC2H5 + H2O
CH3HCOOC2H5 + H2O
Trong phản ứng trên H2SO4 đặc là chất xúc tác.
VI. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.
Ví dụ: Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.
-
Chương 1. Cấu tạo nguyên tử
-
Chương 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chương 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chương 4. Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6. Tốc độ phản ứng hóa học
-
Chương 7. Nguyên tố nhóm VIIA - Halogen
-
Đề thi cuối học kì 2







