Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết.
Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết.
Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm?
Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì < 0.
Cho các phản ứng sau xảy ra ở điều kiện chuẩn:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = -890,36 kJ
= -890,36 kJ
CaCO3(s) → CaO(s) + CO2(s) ![]() = 178,29 kJ
= 178,29 kJ
Ở điều kiện tiêu chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Ta có:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) = -890,36 kJ
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol CH4, sản phẩm là CO2(g) và H2O(l) thì sẽ giải phóng một nhiệt lượng là 890,36 kJ.
CaCO3(s) → CaO(s) + CO2(s) = 178,29 kJ
Để thu được 1 mol CaO(s), cần phải cung cấp nhiệt lượng là 178,29 kJ để chuyển 1 mol CaCO3(s) thành CaO (s).
Vậy ở điều kiện tiêu chuẩn, để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3 cần đốt cháy:
mCH4 = 0,4.16 = 6,4 gam
Cho phản ứng sau ở điều kiện chuẩn:
2H2(g) + O2(g) ![]() 2H2O (g)
2H2O (g)
Tính biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết. Biết E(H-H) = 432 (kJ/mol); E(O=O) = 498kJ/mol; E(H-O) = 476 kJ/mol.
2H – H(g) + O=O(g) 2H– O–H(g)
= 2×Eb(H2) + Eb(O2) − 2×Eb(H2O)
= 2×E(H−H) + E(O=O)− 2×2×E(H−O)
= 2 × 432 + 498 − 2 × 2 × 467
= − 506 (kJ)
Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2 tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phương trình nhiệt hóa học được biểu diễn như sau:
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (cđ).
Ta có phản ứng thu nhiệt nên > 0 và là phản ứng nhiệt phân
Phương trình nhiệt hóa học đúng là:
Cu(OH)2(s) CuO(s) + H2O(l)
= +9,0kJ.
Tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm và cho biết đây là phản ứng tỏa nhiệt hay thu nhiệt.
2Al(s) + Fe2O3(s) ![]() 2Fe(s) + Al2O3(s)
2Fe(s) + Al2O3(s)
Biết ![]() của Fe2O3(s) và Al2O3(s) lần lượt là -825,5 kJ/mol; -1676 kJ/mol.
của Fe2O3(s) và Al2O3(s) lần lượt là -825,5 kJ/mol; -1676 kJ/mol.
=
((Al2O3(s)) + 2.
(Fe(s)) − 2.
(Al(s)) −
(Fe2O3(s))
= (−1676) + 2×0 − 2.0 − (−825,5)
= − 850,5 (kJ)
Vậy = − 850,5 kJ < 0 nên phản ứng tỏa nhiệt.
Cho phản ứng: NH3(g) + HCl(g) ⟶ NH4Cl(s)
Biết ![]() = −314,4 kJ/mol;
= −314,4 kJ/mol; ![]() = −92,31 kJ/mol;
= −92,31 kJ/mol; ![]() = −45,9 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng là
= −45,9 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng là
Ta có:
=
–
–
= −314,4 −(−92,31) − (−45,9)
= −176,19 (kJ)
Cho phản ứng:
3O2(g) ⟶ 2O3(g) (1)
2O3(g) ⟶ 3O2(g) (2)
Biết phân tử O3 gồm 1 liên kết đôi O = O và 1 liên kết đơn O – O.
So sánh ![]() của hai phản ứng là
của hai phản ứng là
Biến thiên enthalpy chuẩn của phản ứng (1) là:
(1) = 3.Eb(O2) − 2.Eb(O3)
= 3.498 − 2.(498+204)
= 90 kJ
(2) = 2.Eb(O3) − 3.Eb(O2)
= 2.(498 + 204)− 3×498
= − 90 (kJ)
Vậy (1) >
(2)
Một bình gas (khí hoá lỏng) chứa hỗn hợp propane và butane với tỉ lệ số mol 1 : 2. Cho biết các phản ứng:
C3H8(g) + 5O2(g) ⟶ 3CO2(g) + 4H2O(g) ![]() = –2220 kJ
= –2220 kJ
C4H10(g) + O2(g) ⟶ 4CO2(g) + 5H2O(g) ![]() = –2874 kJ
= –2874 kJ
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10 000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?
Gọi a là số mol của propane trong bình gas ⇒ 2a là số mol của butane trong bình gas.
Theo bài, ta có:
44a + 58.2a = 12.1000 ⇒ a = 75 mol
Tổng nhiệt lượng tỏa ra khi đốt cháy hoàn toàn một bình gas là:
75.2220 + 2.75.2874 = 597600 kJ
Số ngày mà hộ gia đình sử dụng hết bình gas là:
Cho phản ứng:
4HCl(g) + O2(g) ![]() 2Cl2(g) + 2H2O(g)
2Cl2(g) + 2H2O(g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là bao nhiêu? Phản ứng tỏa nhiệt hay thu nhiệt? Biết Eb (H-Cl) = 427 kJ/mol; Eb (O=O) = 498 kJ/mol; Eb (Cl-Cl) = 243 kJ/mol; Eb (H-O) = 467 kJ/mol.
4H − Cl (g) + O = O(g) 2Cl – Cl(g) + 2H – O – H(g)
Biến thiên enthalpy chuẩn của phản ứng là
= 4.Eb(HCl) + Eb(O2) - 2.Eb(Cl2) - 2.Eb(H2O)
= 4.Eb (H-Cl) + Eb (O=O) - Eb (Cl-Cl) - 2.2.Eb (H-O)
= 4.427 + 498 - 2.243 - 2.2.467
= -148 (kJ)
= -148 < 0 nên phản ứng tỏa nhiệt
Số lượng mỗi loại liên kết trong phân tử C2H6 là
Cấu tạo phân tử C2H6:
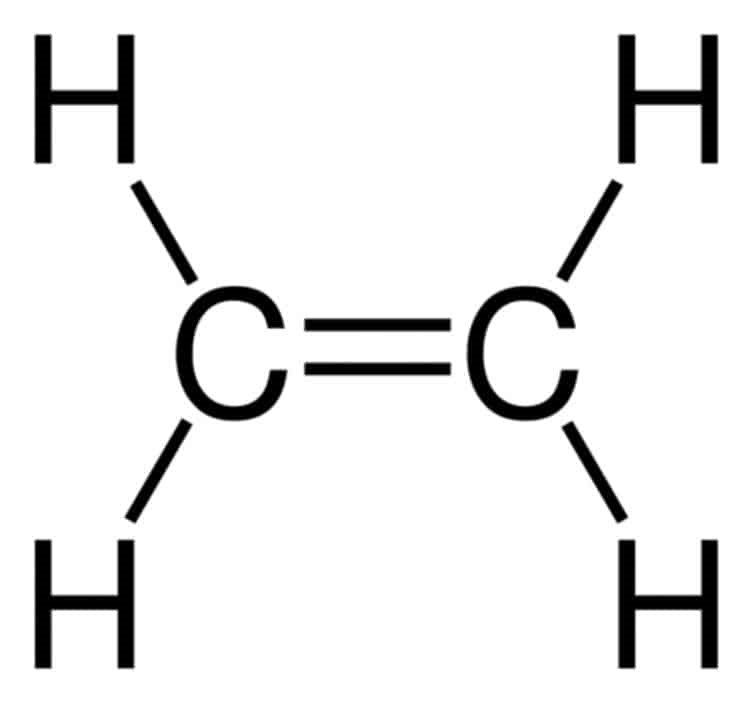
Vậy trong phân tử C2H6 có 6 liên kết C – H, 1 liên kết C – C
Đâu là phương trình nhiệt hóa học?
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
Cho phương trình nhiệt hóa học sau:
2H2(g) + O2(g) ⟶ 2H2O(g) ![]() = -483,64 kJ
= -483,64 kJ
So sánh đúng là
Ta có: =
(sp) −
(cđ)
mà < 0
(sp) <
(cđ)
Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết lại giải phóng năng lượng.
Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là
Cho các phản ứng sau đây:
(a) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g).
b) Cồn cháy trong không khí.
c) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
Chọn kết luận đúng nhất.
(a) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g) là phản ứng thu nhiệt.
b) Cồn cháy trong không khí là phản ứng tỏa nhiệt
c) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật là phản ứng thu nhiệt.
Cho biến thiên enthalpy chuẩn của phản ứng sau là ![]() = -58,4 kJ.
= -58,4 kJ.
PbS(s) + 2HCl(g) ![]() PbCl2(s) + H2S(g)
PbCl2(s) + H2S(g)
Tính nhiệt tạo thành chuẩn của PbCl2(s) biết:
| Chất | PbS(s) | HCl(g) | H2S(g) |
| -98,7 | -95,30 | -33,6 |
Biến thiên enthalpy của phản ứng tính theo công thức:
=
(sp) –
(cđ)
=
(H2S(g)) +
(PbCl2(s)) – 2.
(HCl(g)) –
(PbS(s))
(PbCl2(s)) = –58,4 – (–33,6) + 2.(–95,30) + (–98,7)
(PbCl2(s)) = –314,1 (kJ/mol)
Trong các phát biểu sau
(1) ![]() rH > 0 thì phản ứng thu nhiệt.
rH > 0 thì phản ứng thu nhiệt.
(2) ![]() rH < 0 thì phản ứng tỏa nhiệt.
rH < 0 thì phản ứng tỏa nhiệt.
(3) Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng ít.
(4) Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
Số phát biểu đúng là:
Các phát biểu đúng là (1), (2) và (4).
(3) Sai vì Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
Tính ![]() của phản ứng đốt cháy 1 mol C2H2(g) biết các sản phẩm thu được đều ở thể khí.
của phản ứng đốt cháy 1 mol C2H2(g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
| Chất | C2H2(g) | CO2(g) | H2O(g) |
| +227 | -393,5 | -241,82 |
C2H2(g) + O2(g) ⟶ 2CO2(g) + H2O(g)
= 2.
(CO2(g)) +
(H2O(g)) −
(O2(g)) −
(C2H2(g))
= 2×(−393,5) + (−241,82) − 52×0 − 227
= − 1255,82 (kJ)
Đơn vị của nhiệt tạo thành chuẩn là
