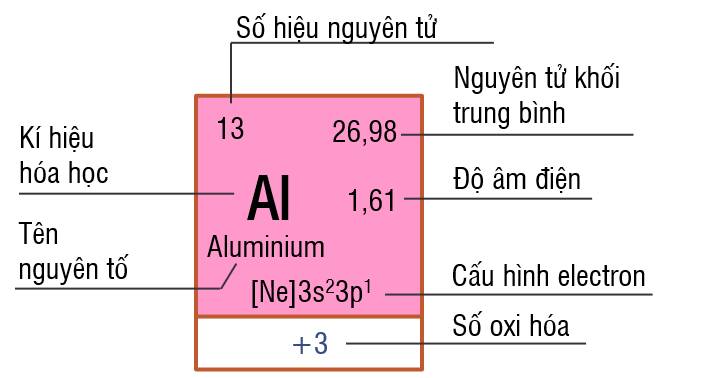
Ô nguyên tố không cho biết thông tin nào sau đây?
Ô nguyên tố không cho biết số khối của hạt nhân.
Tùy theo từng loại bảng, ô nguyên tố cho ta biết một số thông tin như:
Số hiệu nguyên tử
Kí hiệu nguyên tố
Tên nguyên tố
Nguyên tử khối trung bình.
Ngoài ra: Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = số thứ tự ô nguyên tố = số proton = số electron.
Một số loại bảng tuần hoàn còn cho biết độ âm điện, năng lượng ion hóa, ....