Cho phản ứng: 4P + 5O2 ⟶ 2P2O5
Quá trình oxi hóa là
Quá trình oxi hóa là quá trình nhường electron.
Vậy trong phản ứng quá trình khử là:
Cho phản ứng: 4P + 5O2 ⟶ 2P2O5
Quá trình oxi hóa là
Quá trình oxi hóa là quá trình nhường electron.
Vậy trong phản ứng quá trình khử là:
Số oxi hóa của S trong hợp chất KAl(SO4)2 là
Gọi số oxi hóa của S trong hợp chất KAl(SO4)2là x, ta có:
(+1) + (+3) + [x + (-2).4].2 = 0
x = +6
Cho phương trình hóa học: Mg + HNO3 → Mg(NO3)2 + NO↑ + H2O. Tổng hệ số của các chất tham gia trong phản ứng trên là
Quá trình nhường - nhận electron
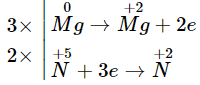
Phương trình hóa học: 3Mg + 8HNO3
3Mg(NO3)2 + 2NO + 4H2O
Tổng hệ số của các chất tham gia trong phản ứng trên là: 3 + 8 = 11.
Hoà tan hoàn toàn 3,25 gam kim loại M hóa trị II trong dung dịch HNO3 dư thu được khí 2,24 lít khí NO2 ở đktc (sản phẩm khử duy nhất) và dung dịch muối nitrat. M là kim loại nào dưới đây?
nNO2 = 0,1 mol
Gọi x là số mol của kim loại M hóa trị II.
Quá trình nhường e M0 → M+2 + 2e x → 2x | Quá trình nhận e N+5 + 1e → N+4 0,1 ← 0,1 |
Áp dụng định luật bảo toàn e ta có
2x = 0,1 => x = 0,05 mol
=> MM = 3,25:0,05 = 65 (Zn)
Số mol electron cần dùng để khử 0,25 mol Fe2O3 thành Fe là
Quá trình nhận electron là:
0,25 1,5
Số mol electron cần dùng là 1,5 mol.
Số oxi hóa của các nguyên tử trong H2, Fe2+, Cl- lần lượt là
Áp dụng các quy tắc xác định số oxi hóa ta có số oxi hóa của các nguyên tử trong H2, Fe2+, Cl- lần lượt là 0, +2, -1.
Để một lượng bột iron ngoài không khí một thời gian thu được 5,68 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4. Hòa tan hoàn toàn hỗn hợp đó bằng dung dịch HNO3 loãng (dư), thu được 0,672 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa m gam muối Fe(NO3)3. Giá trị của m là bao nhiêu?
Quy đổi hỗn hợp oxide Fe thành Fe và O
Gọi x, y lần lượt là số mol của của Fe và O
nNO = 0,06 mol
Quá trình nhường e Fe0 → Fe+3 + 3e x → 3x | Quá trình nhận e O0 + 2e → O-2 x → 2y N+5 + 3e → N+2 0,09 ← 0,03 |
Áp dụng định luật bảo toàn e, ta có:
3x = 2y + 0,09 => 3x - 2y = 0,09 (1)
Mặt khác theo đề bài ta có: 56x + 16y = 5,68 (2)
Giải hệ phương trình (1), (2) ta được:
x = 0,08; y = 0,075
nFe(NO3)3 = nFe = 0,08 mol
=> mFe(NO3)3 = 19,36 gam.
Cho phương trình hóa học của phản ứng: Cl2 + 2NaOH → NaCl + NaOCl + H2O. Trong phản ứng trên, Cl2
Áp dụng quy tắc xác định số oxi hóa ta có:
Vậy Cl2 vừa là chất khử, vừa là chất oxi hóa.
Cho sơ đồ phản ứng sau: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hóa và môi trường trong phản ứng là:
Xác định sự thay đổi số oxi hóa
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
Ta có :
3x 1x | Fe+2 → Fe+3 + 1e N+5 + 3e → N+2 |
Phương trình phản ứng
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Trong 10 phân tử HNO3 phản ứng, có 1 phân tử là chất oxi hóa tạo NO, 9 phân tử làm môi trường tạo muối Fe(NO3)3
Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
Vậy một phân tử CuFeS2 nhường 13 electron.
Hệ số cân bằng của H2 trong phản ứng Fe2O3 + H2 ⟶ Fe + H2O là
Đặt hệ số cho quá trình nhường nhận electron
Phương trình hóa học:
Fe2O3 + 3H2 ⟶ 2Fe + 3H2O
Vậy hệ số của H2 là 3
Cho các phản ứng sau (ở điều kiện thích hợp):
a) SO2 + C → CO2 + S
b) 2SO2 + O2 → 2SO3
c) SO2 + 2NaOH → Na2SO3 + H2O
d) SO2 + H2S → S + H2O
e) SO2 + Br2 + H2O → H2SO4 + HBr
Số phản ứng mà SO2 đóng vai trò chất oxi hóa là
Chất oxi hóa là chất nhận electron.
a) Sự thay đổi số oxi hóa của các nguyên tố:
S nhận electron SO2 là chất oxi hóa.
b)Sự thay đổi số oxi hóa của các nguyên tố:
S nhường electron SO2 là chất khử.
c)
Không có sự thay đổi số oxi hóa của các nguyên tố không phải phản ứng oxi hóa khử.
d)Sự thay đổi số oxi hóa của các nguyên tố:
S nhận electron SO2 là chất oxi hóa.
e) Sự thay đổi số oxi hóa của các nguyên tố:
S nhường electron SO2 là chất khử.
Vậy có 2 phản ứng SO2 đóng vai trò là chất oxi hóa.
Hệ số cân bằng (là các số nguyên, tối giản) của Cu2S và HNO3 trong phản ứng: Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O là
Sự thay đổi số oxi hóa của các nguyên tố:
Phương trình phản ứng:
3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Vậy hệ số cân bằng của Cu2S và HNO3 trong phản ứng là 3 và 22
Cho phản ứng sau: KMnO4 + H2SO4 → MnSO4 + K2SO4 + O2 + H2O. Hệ số (nguyên, tối giản) của chất oxi hóa, chất khử là
Số oxi hóa của các nguyên tố thay đổi:
KMnO4 là chất oxi hóa, H2O2 là chất khử.
Các quá trình nhường nhận electron:
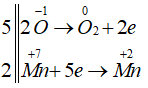
Hệ số của KMnO4 là 2, hệ số của H2O2 là 5.
Xác định hệ số cân bằng của HCl trong phản ứng dưới đây:
K2Cr2O7 + HCl ⟶ Cl2 + KCl + CrCl3 + H2O
Sự thay đổi số oxi hóa của các nguyên tố:
Đặt hệ số cho quá trình nhường nhận electron:
⇒ Phương trình hóa học:
K2Cr2O7 + 14HCl ⟶3Cl2 + 2KCl + 2CrCl3 + 7H2O
Vậy hệ số cân bằng của HCl trong phản ứng là 14.
Số oxi hóa của một nguyên tử trong phân tử được là
Số oxi hóa của một nguyên tử trong phân tử được là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Trong phản ứng: 2NO2 + 2NaOH→ NaNO3 + NaNO2 + H2O, NO2 đóng vai trò
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Áp dụng quy tắc xác định số oxi hóa của nguyên tử các nguyên tố:
NO2 vừa là chất khử, vừa là chất oxi hóa.
Chất khử là chất
Chất khử là chất nhường electron, có số oxi hóa tăng, bị oxi hóa.
Chất oxi hóa là chất nhận electron, có số oxi hóa giảm, bị khử.
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
Xét các phản ứng:
Zn và H có sự thay đổi số oxi hóa phản ứng là phản ứng oxi hóa - khử.
Mg và Cu có sự thay đổi số oxi hóa phản ứng là phản ứng oxi hóa - khử.
Fe và Cu có sự thay đổi số oxi hóa phản ứng là phản ứng oxi hóa - khử.
Các nguyên tử nguyên tố trong phản ứng không có sự thay đổi số oxi hóa phản ứng không phải là phản ứng oxi hóa - khử.
Phản ứng oxi hóa – khử là
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
