Orbital nguyên tử được kí hiệu là
Orbital nguyên tử được kí hiệu là AO (Atomic Orbital).
Orbital nguyên tử được kí hiệu là
Orbital nguyên tử được kí hiệu là AO (Atomic Orbital).
Trong ion dương XY4+ có tổng số hạt bằng 29 và tổng số hạt mang điện dương bằng 11. Nguyên tử X có số hạt mang điện dương nhiều hơn số hạt mang điện dương trong Y bằng 6. Và số hạt không mang điện X nhiều hơn số hạt không mang điện trong Y bằng 7. Tổng số hạt không mang điện của hai nguyên tử X và Y là:
Gọi số hạt trong X là p1, n1 và trong Y là p2, n2 (biết số p = số e).
Trong ion dương XY4+ có tổng số hạt bằng 29:
2p1 + n1 + 8p2 + 4n2 = 29. (1)
Tổng số hạt mang điện dương trong XY4+ bằng 11:
p1 + 4p2 = 11. (2)
Nguyên tử X có số hạt mang điện dương nhiều hơn số hạt mang điện dương trong Y bằng 6.
⟹ p1 – p2 = 6 (3)
số hạt không mang điện X nhiều hơn số hạt không mang điện trong Y bằng 7.
⟹ n1 – n2 = 7 (4)
Từ (1); (2); (3); (4) suy ra p1 = 7, n1= 7, p2= 1, n2 = 0.
Tổng số hạt không mang điện của hai nguyên tử X và Y bằng 7.
Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố gọi là
Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó.
Phát biểu nào sau đây đúng?
Hạt nhân nguyên tử hydrogen chỉ có 1 proton, không có neutron.
Nguyên tử khối của nguyên tử M là 56, ion dương M2+ có số hạt không mang điện là 30. Số hạt mang điện trong ion dương M2+ là:
Gọi số hạt trong M lần lượt là p, n, e.
Nguyên tử khối của nguyên tử M là 56 ⟹ p + n = 56 (1)
Trong ion dương M2+ có số hạt không mang điện là 30 ⟹ n = 30 (2)
Từ (1) và (2): p = 26, n = 30
⟹ Số hạt mang điện trong M2+ là: 26 + 26 – 2 = 50.
Khẳng định sai là
Theo quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
Hình dưới đây cho biết hình dạng của orbital
AO s là orbital có dạng hình cầu.
Nguyên tố Y có 2 lớp electron, lớp thứ hai có 5 electron. Số hiệu nguyên tử của Y là
Có 2 lớp electron ⇒ lớp ngoài cùng là lớp thứ 2.
Mà lớp thứ 2 có 5 electron ⇒ cấu hình electron lớp ngoài cùng là: 2s22p3
⇒ Cấu hình electron đầy đủ là: 1s22s22p3 ⇒ số electron = 2 + 2 + 3 = 7
Số hiệu nguyên tử Z = số electron = 7.
Cấu hình electron của Cu (cho Z = 29) là:
Cu có Z = 29 ⇒ có 29 electron trong nguyên tử
Cấu hình e theo phân mức năng lượng:
1s22s22p63s23p64s23d9
Vì d chứa tối đa 10 e ⇒ 1 e từ 4s2 chuyển qua 3d9 để lớp d bão hòa thành 10 e
⇒ Cấu hình e của Cu là: 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
Phát biểu nào sau đây là đúng?
Các AO có hình dạng khác nhau: AO s có dạng hình cầu, AO p có dạng hình số tám nổi, AO d và f có hình dạng phức tạp.
Nguyên tử R có Z = 24. Cấu hình electron nguyên tử R:
Với Z = 24, e sẽ được phân bố như sau:
1s22s22p63s23p64s23d4
Do sự phân bố này không bền do phân lớp 3d có 4e (gần với cấu hình bán bão hòa) vậy nên sẽ có sự chuyển 1e của phân lớp 4s về 3d (trở thành cấu hình bán bão hòa bền hơn)
Do đó, cấu hình của nguyên tử này là: 1s22s22p63s23p63d54s1
Nguyên tử gồm
Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
Một nguyên tử X có số khối là 80, X có tỉ lệ số hạt mang điện và số hạt không mang điện là 14/9. Số hạt không mang điện là
Số khối của X là 80: p + n = 80 (1)
X có tỉ lệ số hạt mang điện (gồm hạt p và hạt e) và số hạt không mang điện là 14/9:
(2)
Từ (1) và (2) ta có: p = e = 35; n = 45.
Một kim loại M có số khối A = 54. Tổng số các hạt cơ bản trong nguyên tử M là 80. Kim loại M là
Số khối A = Z + N = 54 (1)
Tổng số hạt cơ bản của M là 80
P + E + N = 80 hay 2Z + N = 80 (2)
Từ (1) và (2) ta có:
Z = 26 và N = 28
Có Z = 26 kim loại M là Fe
Một nguyên tử nitrogen có khối lượng là 14,0067 amu. Khối lượng của nguyên tử theo đơn vi kg là
1 amu = 1,661.10-27 kg
14,0067 amu = 14,0067.1,661.10-27
= 2,3265.10-26 kg.
Nguyên tử fluorine có 9 electron, hạt nhân nguyên tử này có điện tích là
Nguyên tử fluorine có 9 electron mà mỗi electron có điện tích quy ước là – 1.
⇒ Số đơn vị điện tích âm là 8.
Số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
⇒ Số đơn vị điện tích dương của hạt nhân = Số đơn vị điện tích âm = 8.
Do đó, hạt nhân nguyên tử này có điện tích là + 8.
Nguyên tử nào sau đây được biểu diễn cấu hình electron biểu diễn theo ô orbital:
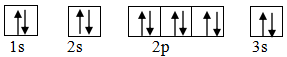
Từ cấu hình electron biểu diễn theo ô orbital ta thấy mỗi electron biểu diễn bằng một mũi Vậy nguyên tử cần tìm là Magnesium.
Cho các phát biểu sau:
(1) Tất cả hạt nhân nguyên tử của các nguyên tố đều luôn có hai loại hạt cơ bản là proton và neutron.
(2) Khối lượng nguyên tử tập trung ở lớp vỏ electron.
(3) Số khối (A) có thể có giá trị lẻ.
(4) Trong nguyên tử, số electron bằng số proton.
(5) Trong hạt nhân nguyên tử, hạt mang điện là proton và electron.
Số phát biểu sai là:
(1) Sai vì nguyên tử 11H chỉ có 1 proton trong hạt nhân, không có hạt neutron.
(2) Sai vì khối lượng nguyên tử tập trung ở hạt nhân nguyên tử.
(3) Sai vì số khối bằng tổng số hạt proton (Z) và tổng số neutron (N) mà số lượng các hạt Z, N đều là số nguyên dương nên không thể là số lẻ.
(4) Đúng.
(5) Sai vì trong nguyên tử (chứ không phải trong hạt nhân) hạt mang điện là proton và electron.
Vậy các phát biểu sai là (1), (2), (3), (5).
Nguyên tử X, ion Y2+ và ion Z- đều có cấu hình electron 1s22s22p6. X, Y, Z là gì?
Cấu hình e của Y: 1s22s22p63s2 (có 2 e lớp ngoài cùng)
Cấu hình e của Z: 1s22s22p5 (có 7 e lớp ngoài cùng).
Khi nguyên tử có 1,2,3 e lớp ngoài cùng là kim loại, có 5,6,7 e lớp ngoài cùng là phi kim
X là khí hiếm, Y là kim loại, Z là phi kim
Nguyên tố bromine có 2 đồng vị ![]() chiếm 49,5% về số lượng nguyên tử, còn lại là
chiếm 49,5% về số lượng nguyên tử, còn lại là ![]() . Nguyên tử khối trung bình của bromine là:
. Nguyên tử khối trung bình của bromine là:
Thành phần phần trăm về số lượng nguyên tử của đồng vị là:
100% − 49,5% = 50,5%
Nguyên tử khối trung bình của bromine là:
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết:
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết số khối A và số hiệu nguyên tử Z.
Nguyên tử N có Z = 7. Số electron độc thân trong nguyên tử N là
Cấu hình electron nguyên tử của N là: 1s22s22p3
Cấu hình theo ô orbital của N là:
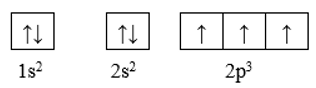
Như vậy nguyên tử N có 3 electron độc thân thuộc AO 2p.
Cho các nguyên tử X, Y, Z, T có đặc điểm như sau:
(1) Nguyên tử Z có 17 proton và số khối bằng 35.
(2) Nguyên tử Y có 17 neutron và số khối bằng 33.
(3) Nguyên tử Z có 17 neutron và 15 proton.
(4) Nguyên tử T có 20 neutron và số khối bằng 37.
Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
Theo bài ra ta có:
Nguyên tử X có 17 proton, nguyên tử Y có 16 proton, nguyên tử Z có 15 proton, nguyên tử T có 17 proton
Nguyên tử X và T là đồng vị của cùng một nguyên tố hóa học (đều có 17proton)
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 5. Nguyên tố X là
Nguyên tử nguyên tố X có ∑e phân lớp p = 8
X có cấu hình electron là: 1s22s22p63s23p2
Z = 14 (Si)
Một nguyên tử có 12 proton và 12 neutron trong hạt nhân. Điện tích của ion tạo thành khi nguyên tử này bị mất 2 electron là
- Nguyên tử trung hòa về điện.
- Electron mang điện tích (-) Khi nguyên tử mất 2 electron tạo thành ion có điện tích 2+.
Nguyên tử fluorine chứa 9 electron và có số khối là 19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
Số hạt electron = số hạt proton = 9
Số khối A = Số proton + số neutron
⇒ Số neutron = 19 – 9 = 10
⇒ Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là:
9 + 9 + 10 = 28 hạt.
Nguyên tố hóa học là
Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
Cho hợp chất MX2. Trong phân tử MX2 có tổng số hạt cơ bản là 140 và số hạt mang điện nhiều hơn số hạt không mang điện là 44, Số khối của X lớn hơn số khối của M là 11. Tổng số hạt cơ bản trong X nhiều hơn trong M là 16. Xác định công thức MX2.
Tổng số các hạt trong phân tử là 140
→ 2Z M + N M + 2.(2Z X + N X ) = 140 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt
→ 2Z M + 4Z X - N M - 2.N X = 44 (2)
Giải hệ (1), (2) → 2Z M + 4Z X = 92 và NM + 2N X = 48
Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt
→ 2Z X + N X - (2Z M + N M ) = 16 (3)
Số khối của X lớn hơn số khối của M là 11
→ (Z X + N X )- (Z M + N M ) = 11 (4)
Lấy (3) - (4) → Z X - Z M = 5
Ta có hệ:
⇒ ZM= 12; ZX = 17
M là Mg và X là Cl
Vậy công thức của MX2 là MgCl2.
Ion X3+ có tổng số hạt cơ bản là 38 hạt. Vậy X là
X3+ có tổng hạt cơ bản là 38 ⟹ X có tổng hạt cơ bản là 38 + 3 = 41
⟹ 2Z + N = 41 ⟹ N = 41 - 2Z
Các nguyên tố có Z ≤ 82 luôn có: Z ≤ N ≤ 1,5Z
⟹ Z ≤ 41 - 2Z ≤ 1,5Z
⟹ 11,7 ≤ Z ≤ 13,7
Vậy Z = 12 (Mg) hoặc Z = 13(Al)
Lithium có 2 đồng vị là 7Li và 6Li. Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là:
Gọi phần trăm số nguyên tử của đồng vị 7Li là x%
⇒ phần trăm số nguyên tử của đồng vị 6Li là (100 − x)%
Ta có:
Vậy phần trăm số nguyên tử của đồng vị 7Li là 93%.
Trong các câu sau đây, câu nào không đúng?
Câu không đúng là: Nguyên tử khối bằng số neutron trong hạt nhân.
Hợp chất R được tạo thành từ các ion X3+ và Y2- (X, Y là kí hiệu các nguyên tố chưa biết). Tổng số hạt proton, neutron, electron trong một phân tử A bằng 224, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 64 hạt. Số khối của X lớn hơn số khối của Y là 36 đơn vị. Tổng số hạt proton, neutron, electron trong X3+ nhiều hơn trong Y2- là 47 hạt. Công thức phân tử của R là:
Công thức tổng quát của A là: X2Y3. Gọi số hạt proton, neutron và electron trong R lần lượt là P, N, E
⇒ 2PX + 3PY = 72 (1)
Số khối của X lớn hơn số khối của Y là 36 đơn vị:
(PX + NX) - (PY + NY) = 36
→ (PX – PY) + (NX – NY) = 36 (2)
Tổng số hạt proton, neutron, electron trong X3+ nhiều hơn trong Y2- là 47 hạt:
(2PX + NX -3) - (2PY + NY + 2) = 47
→ 2(PX – PY) + (NX – NY) = 52 (3)
Giải hệ phương trình gồm (2) và (3) ta có:
PX – PY = 16 (4) và NX – NY = 20
Giải hệ phương trình gồm (1) và (4) ta có:
PX = ZX = 24 (Cr) và PY = ZY = 8 (O)
→ Công thức oxit cần tìm là: Cr2O3
Nguyên tử nào sau đây là đồng vị của ![]() ?
?
- Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số pryon (P), cùng số hiệu nguyên tử (Z) nhưng khác nhau về số neutron (N). Do đó số khối (A) của chúng khác nhau
Đồng vị của
là
.
Nguyên tử ![]() có:
có:
Ta có:
Số khối là A = 39; số hiệu nguyên tử Z = 19
Số p = số e = 19
Lại có: A = Z + N N = A - Z = 30 - 19 = 20
Số n = 20
Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là:
Theo mô hình hiện đại, trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
Phân tử MX3 có tổng số hạt proton, neutron và electron bằng 196, trong đó hạt mang điện nhiều hơn số hạt không mang điện là 60. Khối lượng nguyên tử của X lớn hơn của M là 8. Tổng số hạt trong X- nhiều hơn trong M3+ là 16. Số khối của X là
Phân tử MX3 gồm 1 nguyên tử M và 3 nguyên tử X nên tổng số hạt là:
(2.ZM + NM) + 3.(2.ZX + NX) = 196 (1)
Trong phân tử MX3, số hạt mang điện nhiều hơn không mang điện là 60 nên:
2.ZM + 3.2.ZX – (NM + 3.NX) = 60 (2)
Từ (1) và (2) ta có:
Khối lượng nguyên tử của X lớn hơn của M là 8
AX – AM = 8
ZX + NX – (ZM + NM) = 8 (5)
Tổng số hạt trong X- nhiều hơn trong M3+ là 16 nên:
2ZX + NX + 1 – (2.ZM + NM – 3) = 16 (6)
Từ (5) và (6):
Từ (3) và (7) ZX = 17 và ZM = 13
Từ (4) và (8) NX = 18 và NM = 14
Số khối của X là AX = ZX + NX = 17 + 18 = 35
Phân lớp nào sau đây bán bão hòa?
Phân lớp bán bão hòa là phân lớp có số electron bằng 1 nửa số e bão hòa của phân lớp đó.
Do phân lớp d có tối đa 10e nên phân lớp 4d5 là bán bão hòa.
Cấu hình electron nào sau đây là của khí hiếm?
Nguyên tử có cấu hình electron 1s22s22p63s23p6 có 8 electron ở lớp ngoài cùng nên là cấu hình hình electron của khí hiếm.
Nguyên tử X có cấu hình electron 1s22s22p63s23p5. Khẳng định sai là:
Tổng số electron trên các phân lớp là 2 + 2 + 6 + 2 + 5 = 17 (electron) nên nguyên tử X có 17 electron.
Phân lớp 3p có 5 electron chưa đủ số electron tối đa (6 electron) nên phân lớp 3p chưa bão hòa.
Lớp ngoài cùng là lớp thứ 3 có tổng số electron là 2 + 5 = 7 (electron) nên nguyên tử X có 7 electron ở lớp ngoài cùng.
Lớp ngoài cùng là lớp thứ 3 nên nguyên tử X có 3 lớp electron.
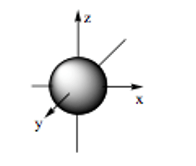
Nếu xem nguyên tử như một quả cầu thì khẳng định nào dưới đây là đúng?
Nếu xem nguyên tử như một quả cầu, trong đó các electron chuyển động rất nhanh xung quanh hạt nhân thì nguyên tử đó có đường kính khoảng 10-10 m và đường kính hạt nhân khoảng 10-14 m. Như vậy, đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10000 lần.
