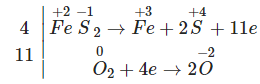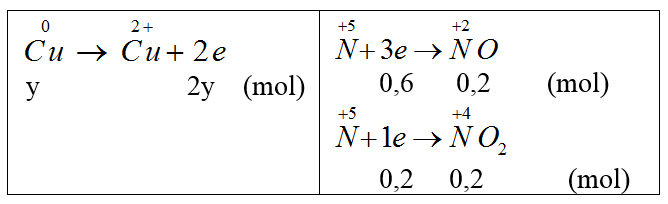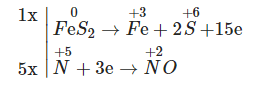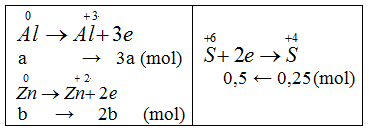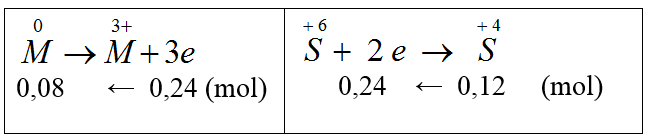Hòa tan hoàn toàn một lượng 31,32 gam một oxit Fe bằng dung dịch H2SO4 đặc, nóng thu được dung dịch A và 4,872 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch A, thu được m gam muối Fe2(SO4)3 khan. Xác định giá trị m là:
Hướng dẫn:
Quy đổi hỗn hợp oxide Fe thành Fe và O
Gọi x, y lần lượt là số mol của của Fe và O
nSO2 = 4,872 : 22,4 = 0,2175 mol
Quá trình nhường e Fe0 → Fe+3 + 3e x → 3x | Quá trình nhận e O0 + 2e → O-2 x → 2y S+6 + 2e → S+4 0,435 ← 0,2175 |
Áp dụng định luật bảo toàn electron, ta có:
3x = 2y + 0,29 → 3x - 2y = 0,435 (1)
Ta có theo đề bài: 56x + 16y = 31,32 (2)
Từ (1) và (2) → x = 0,435 và y = 0,435
Áp dụng định luật bảo toàn nguyên tố ta có:
nFe2(SO4)3 = 1/2nFe = 0,2175 mol
→ mFe2(SO4)3 = 0,2175. 400 = 87 (g)
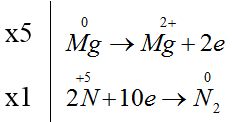
a = 5, b = 12