Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì phi kim mạnh nhất là fluor.
Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì phi kim mạnh nhất là fluor.
Biểu diễn sự tạo thành ion nào sau đây đúng?
Sai vì Ca có 2 electron lớp ngoài cùng. Khi tham gia hình thành liên kết hóa học Ca có xu hướng nhường đi 2 electron.
Sửa lại: Ca → Ca2+ + 2e
Sai vì Cl có 7 electron lớp ngoài cùng. Có xu hướng nhận thêm 1 electron khi hình thành liên kết hóa học.
Sửa lại: Cl2 + 2e → 2Cl-
Sai vì 1 nguyên tử S nhận 2 electron để tạo thành ion S2-
Sửa lại: S + 2e → S2-
Đúng vì Mg có 2 electron lớp ngoài cùng, có xu hướng nhường đi 2 electron khi hình thành liên kết hóa học.
Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình
Vậy Calcium là kim loại điển hình tác dụng với Oxygen phi kim điển hình.
Cho dãy chất sau: NaOH, KOH , Mg(OH)2, Al(OH)3. Dãy nào được sắp xếp theo chiều tăng dần tính bazơ của chúng?
Trong cùng một chu kì theo chiều tăng của điện tích hạt nhân tính base giảm dần
Al(OH)3 < Mg(OH)2 < NaOH (1)
Trong cùng một nhóm theo chiều tăng của điện tích hạt nhân tính base tăng dần
NaOH < KOH (2)
Như vậy từ (1) và ) ta có tính base Al(OH)3 < Mg(OH)2 < NaOH < KOH.
Hai nguyên tố A và B cùng thuộc một nhóm A và ở hai chu kỳ kế tiếp nhau (ZA < ZB) có tổng số proton là 24. Vậy số proton của hai nguyên tố A và B lần lượt là:
A và B là hai nguyên tố ở cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn nên số thứ tự của chúng hơn kém nhau 8 hoặc 18 đơn vị (đúng bằng số nguyên tố trong một chu kỳ).
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 24 nên
ZA + ZB = 24.
Trường hợp 1: ZB - ZA = 8.
Ta tìm được ZA = 8; ZB = 16.
Cấu hình electron:
A : 1s22s22p63s2 (chu kì 3, nhóm IIA).
B: 1s22s22p63s23p64s2 (chu kì 4, nhóm IIA).
A và B cùng nhóm thỏa mãn
Trường hợp 2: ZB - ZA = 18.
Ta tìm được ZA = 3; ZB = 21.
Cấu hình electron:
A : 1s22s1 (chu kì 2, nhóm IA).
B: 1s22s22p63s23p63d14s2 (chu kì 4, nhóm IIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
y số proton của hai nguyên tố A và B lần lượt là 8 và 16
Nguyên tử của nguyên tố X có tổng số electron ở phân lớp p là 10. Nguyên tố X thuộc loại
Tổng số electron ở phân lớp p là 10 ⇒ Cấu hình electron của X là 1s22s22p63s23p4
Nguyên tố X thuộc loại nguyên tố p.
Tên gọi của lớp electron thứ hai (n = 2) là
Lớp electron được kí hiệu thứ tự 1, 2, 3 ...7 với tên gọi là các chữ in hóa như sau:
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Tên lớp | K | L | M | N | O | P | Q |
Trong phân tử CO2, có bao nhiêu cặp electron dùng chung?
Nguyên tử carbon (C) có cấu hình electron là 1s22s22p2, nguyên tử oxygen (O) có cấu hình electron là 1s22s22p4.
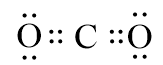
→ Số cặp electron dùng chung trong phân tử CO2 là 4
Y2- có cấu hình electron là: 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn là
Y0 + 2e → Y2-
Y2- có cấu hình electron là: 1s22s22p63s23p6
→ Cấu hình electron Y là: 1s22s22p63s23p4
Vị trí của Y trong bảng tuần hoàn là: Chu kì 3 vì có 3 lớp electron, nhóm VIA (có 6 electron lớp ngoài cùng và electron cuối cùng điền vào phân lớp p)
Trong phân tử nào dưới đây có chứa ion đa nguyên tử?
Ion đa nguyên tử được tạo thành từ nhiều nguyên tử.
Ion đa nguyên tử là NH4+
Đối với bảng tuần hoàn hiện nay, các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
Oxit cao nhất của một nguyên tử R ứng với công thức RO2. Trong hợp chất của nguyên tố đó với H có 75%R và 25%H. Nguyên tố R đó là:
Oxide cao nhất của nguyên tố R có dạng RO2 nên R thuộc nhóm IVA.
Hợp chất với hydrogen là RH4.
Theo bài ra, ta có:
⇒ R = 12.
Vậy R là Carbon (C)
Kí hiệu hóa học biểu thị đầy đủ đặc trưng cho nguyên tử của nguyên tố hóa học vì nó cho biết:
Kí hiệu hóa học biểu thị đầy đủ đặc trưng cho nguyên tử của nguyên tố hóa học vì nó cho biết số A và số hiệu nguyên tử Z
Cation M+ có cấu hình electron là 1s22s22p6 liên kết với nguyên tử oxygen để tạo thành hợp chất M2O. Loại liên kết trong hợp chất này là:
M0 → M+ + 1e
Cấu hình electron của M+ 1s22s22p6
Cấu hình electron của M 1s22s22p63s1 ⇒ M là Na là kim loại điện hình liên kết với nguyên tử oxygen tạo ra hợp chất Na2O.
⇒ Loại liên kết trong hợp chất này là liên kết ion
Nguyên tử của nguyên tố sulfur có Z = 16. Hydroxide cao nhất của nguyên tố này có
Cấu hình electron của nguyên tử nguyên tố sulfur (S): 1s22s22p63s23p4.
⇒ Nguyên tố S nằm ở ô 16, chu kì 3, nhóm VIA của bảng tuần hoàn.
⇒ Hóa trị cao nhất của nguyên tố S là VI.
⇒ Công thức hydroxide của S là H2SO4 (có tính acid mạnh).
Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 23. Xác định tên nguyên tố X, Y trong bảng tuàn hoàn:
X và Y đứng kế tiếp nhau trong cùng một chu kì nên số proton của chúng chỉ khác nhau 1 đơn vị.
Giả sử ZX < ZY, ta có ZY = ZX + 1 (1)
Theo bài ra, tổng số điện tích hạt nhân của X và Y là 25 nên:
ZX + ZY = 23 (2)
Từ (1) và (2) có ZX = 11 và ZY = 12.
X là sodium (Na).
Y là magnesium (Mg).
Nguyên tố Y có Z = 30. Vị trí của Y trong bảng hệ thống tuần hoàn là:
Cấu hình elecctron nguyên tử của Y (Z = 30): 1s22s22p63s23p63d104s2.
Số thứ tự ô = Z = 30.
Số thứ tự chu kì = số lớp e = 4 → Chu kì 4.
Cấu hình electron phân lớp ngoài cùng và sát ngoài cùng là 3d104s2.
Tổng số electron thuộc 2 phân lớp 3d và 4s là 12 → Y thuộc nhóm IIB.
Nguyên tố Y nằm ở ô 30, chu kì 4, nhóm IIB trong bảng tuần hoàn.
Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen ở nhóm VIA có xu hướng
Oxygen có cấu hình electron: 1s22s22p4.
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron để đạt lớp vỏ thỏa mãn quy tắc octet.
Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất?
Ta có Be, B, N, O thuộc cùng chu kì 2, dựa vào quy luật biến đổi có độ âm điện trong 1 chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
Be < B < N < O (1)
Vậy oxigen (O) có độ âm điện lớn nhất
Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với dung dịch HCl dư thì thu được 7,437 lít khí H2 ở (đkc). Hãy xác định hai kim loại.
Gọi công thức chung 2 kim loại là M có khối lượng mol trung bình là
M + 2HCl → MCl2 + H2
Ta thấy: nM = nH2 = 7,437 : 24,79 = 0,3 mol
= 8,8 : 0,3 = 29,33
→ 24 (Mg) < 29,33 < 40 (Ca)
Vậy 2 kim loại đó là Mg và Ca.
Cho 2,3 gam kim loại X thuộc nhóm IA vào H2O thấy giải phóng 0,1 gam khí H2. Kim loại
X là
nH2 = 0,1 : 2 = 0,05 mol
Phương trình tổng quát có dạng:
2X + 2H2O → 2XOH + H2
Theo tỉ lệ phương trình phản ứng ta có:
nX = 2.nH2 = 0,05.2 = 0,1 mol
⇒ MX = 2,3:0,1 = 23 gam/mol
Kim loại cần tìm là Na
Phát biểu nào sau đây đúng khi nói về ba nguyên tử: ![]() ?
?
Y, Z có cùng số neutron sai vì: nY = 18, nZ = 20
Y và Z có số khối khác nhau
X và Y có cùng số neutron sai vì: nX = 13, nY = 18
X, Z là hai đồng vị của cùng một nguyên tố hoá học vì có cùng số proton là 17
Cation R2+ có tổng số hạt electron, neutron và proton bằng 80. Trong nguyên tử R có số
hạt mang điện nhiều hơn số hạt không mang điện 22 hạt. Số khối của R là
Theo đề bài ta có:
Cation R2+ có tổng số hạt electron, neutron và proton bằng 80
p + e + n - 2 = 80 (vì số p = số e)
⇔ 2p + n = 82 (1)
Trong nguyên tử R có số hạt mang điện nhiều hơn số hạt không mang điện 22 hạt
2p - n = 22 (2)
Giải hệ phương trình (1) và (2) ta được
p = 26, n = 30
Số khối A = n + Z = 30 + 26 = 56
Cho công thức oxide ứng với hóa trị cao nhất của X là XO3, trong đó X chiếm 40% về khối lượng. Cho các phát biểu sau:
(1) X có hóa trị cao nhất với oxygen là 6.
(2) Công thức hợp chất khí của X với H có dạng
XH2.
(3) X là một phi kim.
(4) Acid tương ứng với oxide cao nhất của X là H2SO3.
Số phát biểu đúng là
Công thức oxide ứng với hóa trị cao nhất của X là XO3 ⇒ X có hóa trị cao nhất với oxygen là 6 ⇒ X thuộc nhóm VIA
Công thức hợp chất khí của X với H có dạng XH2.
Công thức oxide ứng với hóa trị cao nhất của X là XO3, trong đó X chiếm 40% về khối lượng
⇒
⇒ Mx = 32 ⇒ X là sulfur (S)
Acid tương ứng với oxide cao nhất của X là H2SO4.
Dãy gồm các phân tử đều có liên kết ion là
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion dược hình thành giữa kim loại điển hình và phi kim điển hình.
Xét từng nhóm
+ Cl2, N2, I2, HCl
Loại vì tất cả đều có liên kết cộng hóa trị.
+ HCl, H2S, NaCl, CO2
Loại vì HCl, H2S, CO2 có liên kết cộng hóa trị.
+ MgO, H2SO4, H3PO4, HCl.
Loại vì H2SO4, H3PO4, HCl có liên kết cộng hóa trị.
Trong phân tử HF, nguyên tử hydrogen và fluorine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
H (Z = 1): 1s1 khi hình thành liên kết trong phân tử HF, H đã đạt cấu hình electron bền của khí hiếm helium với 2 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p6 khi hình thành liên kết trong phân tử HF, F đã đạt cấu hình electron bền của khí hiếm neon.
Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng
Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng nhường 1, 2 hoặc 3 electron lớp ngoài cùng để tạo thành ion dương tương ứng có 8 electron lớp ngoài cùng.
X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là
Cấu hình electron nguyên tử X là: [He]2s22p4 X là phi kim, thuộc nhóm VIA
Cấu hình electron nguyên tử Y là: [Ar]4s1 Y là kim loại, thuộc nhóm IA.
Cấu hình electron nguyên tử Z là: [Ne]3s23p4 Z là phi kim, thuộc nhóm VIA.
Liên kết hình thành giữa X và Y; Y và Z là liên kết ion.
Liên kết hình thành giữa X và Z là liên kết cộng hóa trị có cực.
Chất nào chỉ chứa liên kết đơn?
N2: N ≡ N
CO2: O=C=O
O2: O=O
CH4: 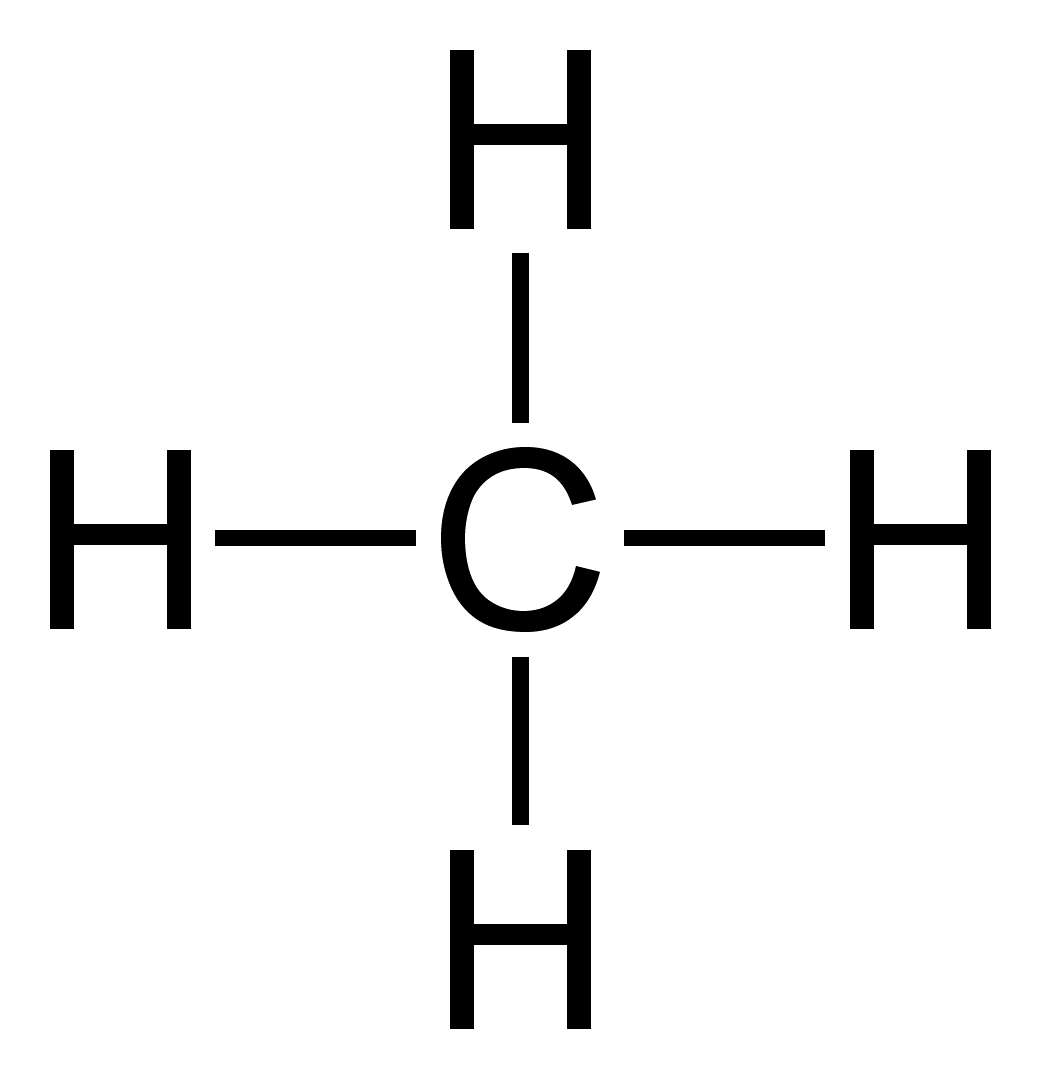
Phân tử chất nào sau đây ít phân cực nhất?
HF có: = 3,98 - 2,2 = 1,78
HCl có: = 3,16 - 2,2 = 0,96
HBr có: = 2,96 - 2,2 = 0,76
HCl có: = 2,66 - 2,2 = 0,46
Chất có liên kết phân cực ít nhất thì nhỏ nhất
HI có liên kết phân cực ít nhất.
So với N2, khí NH3 tan được nhiều trong nước hơn vì:
So với N2, khí NH3 tan được nhiều trong nước hơn vì NH3 tạo được liên kết hydrogen với nước.
Cho ion Al3+ và SO42-. Công thức của hợp chất ion được tạo thành từ 2 ion đã cho là
Công thức của hợp chất ion được tạo thành từ 2 ion đã cho có dạng: Alx(SO4)y
Tổng điện tích của các ion trong hợp chất bằng 0 nên ta có:
3x + (-2).y = 0
⇒ 3x = 2y
⇒
⇒ Lấy x = 2; y = 3
Vậy công thức là: Al2(SO4)3
Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
Sulfur (Z = 16) có cấu hình electron: 1s22s22p63s23p4 ⇒ là phi kim với 6 electron lớp ngoài cùng ⇒ có xu hướng nhận 2 electron để đạt được cấu hình electron bền vững.
Neon (Z = 10) có cấu hình electron: 1s22s22p6⇒ là khí hiếm với 8 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Carbon (Z = 6) có cấu hình electron: 1s22s22p2⇒ là phi kim với 4 electron lớp ngoài cùng ⇒ có xu hướng nhận 4 electron để đạt được cấu hình electron bền vững.
Magnesium (Z = 12) có cấu hình electron: 1s22s22p63s2 ⇒ là kim loại với 2 electron lớp ngoài cùng ⇒ có xu hướng nhường 2 electron để đạt được cấu hình electron bền vững.
Số electron tối đa ở lớp thứ n (n ≤ 4) là
Số electron tối đa ở lớp thứ n (n ≤ 4) là 2n2
Ví dụ:
Số electron tối đa ở lớp thứ ba (n = 3) là 2.32 = 18
Hạt được tìm thấy ở lớp vỏ nguyên tử là
Hạt được tìm thấy ở lớp vỏ nguyên tử là electron mang điện tích âm.
Cho 5,6 gam oxide của kim loại X (thuộc nhóm IIA) tác dụng vừa đủ với 200 ml dung dịch HCl 1M. Kim loại X là
X thuộc nhóm IIA ⇒ hóa trị II
⇒ Công thức oxide có dạng: XO
nHCl = 0,2.1 = 0,2 (mol)
Phương trình có dạng
XO + 2HCl ⟶ XCl2+ H2O
0,1 ← 0,2 (mol)
MXO= 5,6 : 0,1 = 56 (g/mol)
Mà MXO= MX + 16 ⇒ MX + 16 = 56 ⇒ MX= 40 (g/mol)
Vậy X là Ca
Y thuộc chu kì 3, nhóm IIA. Công thức oxide và hydroxide cao nhất của Y lần lượt là
Hóa trị cao nhất của các nguyên tố thuộc nhóm IA đến VIIA (trừ F) = số thứ tự của nhóm.
Y thuộc chu kì 3, nhóm IIA ⇒ Y là kim loại và hóa trị cao nhất của Y là 2
Công thức oxide cao nhất là: YO
Công thức hydroxide cao nhất là Y(OH)2
Nguyên tố Y ở chu kì 3, nhóm IA trong bảng tuần hoàn. Tính chất hóa học cơ bản của Y là:
Y ở chu kì 3, nhóm IA trong bảng tuần hoàn ⇒ Y là kim loại điển hình.
X, Y là những nguyên tố có đơn vị điện tích hạt nhân lần lượt là 11, 16. Công thức và liên kết hợp chất tạo thành từ X và Y là
Cấu hình electron nguyên tử X (Z = 11): 1s22s22p63s1
→ X là kim loại nhóm IA.
→ X có xu hướng nhường 1 electron khi hình thành liên kết hóa học:
X → X+ + 1e
Cấu hình electron nguyên tử Y (Z = 16): 1s22s22p63s23p4
→ Y là phi kim nhóm VIA.
→ Y có xu hướng nhận 2 electron khi hình thành liên kết hóa học:
Y + 2e → Y2-
Vậy hợp chất tạo thành là X2Y, liên kết trong hợp chất là liên kết ion.
Chất nào sau đây có liên kết cộng hóa trị có cực?
Cl2 và O2 có liên kết cộng hóa trị không phân cực
NaCl phân tử có liên kết ion giữa kim loại điển hình và phi kim điển hình
Liên kết của NH3 tạo bởi 2 phi kim khác nhau là N và H ⇒ Liên kết cộng hóa trị.
Xác định hiệu độ âm điện:
Δχ(N−H) = |3,04−2,2| = 0,84
Ta có 0,4 < 0,84 < 1,7
⇒ liên kết cộng hóa trị phân cực
