Cho phản ứng: 4P + 5O2 ⟶ 2P2O5
Quá trình oxi hóa là
Quá trình oxi hóa là quá trình chất khử nhường electron.
Vậy quá trình oxi hóa của phản ứng trên là
Cho phản ứng: 4P + 5O2 ⟶ 2P2O5
Quá trình oxi hóa là
Quá trình oxi hóa là quá trình chất khử nhường electron.
Vậy quá trình oxi hóa của phản ứng trên là
Cho sơ đồ phản ứng :
Fe3O4 + HNO3 → Fe(NO3)3 + NO+ H2O
Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây?
+
+
cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
hệ số cân bằng là: 3, 28, 9, 1, 14
Chất khử là chất
Chất khử là chất nhường electron, có số oxi hóa tăng, bị oxi hóa.
Chất oxi hóa là chất nhận electron, có số oxi hóa giảm, bị khử.
Phản ứng oxi hóa - khử là
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự dịch chuyển electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
Hệ số cân bằng của H2 trong phản ứng: Fe2O3 + H2 ⟶ Fe + H2O là
Bước 1:
Bước 2:
Bước 3:
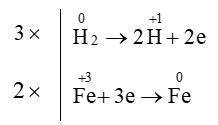
Bước 4: Fe2O3 + 3H2⟶ 2Fe + 3H2O
Ở phản ứng nào sau đây NH3 không đóng vai trò chất khử?
- Ở các phản ứng:
4NH3 + 5O2 4NO + 6H2O;
2NH3 + 3Cl2 N2 + 6HCl;
NH3 + 3CuO 3Cu + N2 + 3H2O
NH3 có số oxi hóa tăng NH3 đóng vai trò chất khử.
- Ở phản ứng 2NH3 + H2O2 + MnSO4 MnO2 + (NH4)2SO4 đóng vai trò là môi trường.
Số oxi hóa của các nguyên tử trong H2, Fe2+, Cl- lần lượt là
Ta có:
Hoà tan hoàn toàn 3,25 gam kim loại M hóa trị II trong dung dịch HNO3 dư thu được khí 2,24 lít khí NO2 ở đktc (sản phẩm khử duy nhất) và dung dịch muối nitrat. M là kim loại nào dưới đây?
nNO2 = 0,1 mol
Gọi x là số mol của kim loại M hóa trị II.
Quá trình nhường e M0 → M+2 + 2e x → 2x | Quá trình nhận e N+5 + 1e → N+4 0,1 ← 0,1 |
Áp dụng định luật bảo toàn e ta có
2x = 0,1 => x = 0,05 mol
=> MM = 3,25:0,05 = 65 (Zn)
Cho phản ứng: Fe + CuSO4 ⟶ Cu + FeSO4.
Khẳng định đúng là
Cu2+ (CuSO4) có số oxi hóa giảm sau phản ứng ⇒ Cu2+ đã nhận electron ⇒ Chất oxi hóa là Cu2+
Fe có số oxi hóa tăng sau phản ứng ⇒ Fe đã nhường electron ⇒ Chất khử là Fe.
Cho nguyên tố X có số oxi hóa có giá trị là -2. Cách biểu diễn đúng là
Cách biểu diễn số oxi hóa:
- Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
- Dấu điện tích được đặt ở phía trước, số ở phía sau.
Do đó, nguyên tố X có số oxi hóa có giá trị là âm 2 được biểu diễn là:
Số oxi hóa của một nguyên tử trong phân tử được định nghĩa là
Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Trong hợp chất H2SO4, số oxi hoá của sulfur (lưu huỳnh) là
Trong H2SO4:
2.(+1) + x + 4.(-2) x = +6
Phát biểu nào sau đây sai khi nói về số oxi hóa trong hợp chất?
Trong hợp chất, số oxi hóa của O thường là –2 (trừ một số trường hợp như OF2, H2O2, …)
Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
Vậy 1 phân tử CuFeS2 nhường 13e.
Cho các phản ứng hóa học sau:
(1) CaCO3 ![]() CaO + CO2.
CaO + CO2.
(2) 2KClO3 ![]() 2KCl + 3O2.
2KCl + 3O2.
(3) 2NaNO3 ![]() 2NaNO2 + O2.
2NaNO2 + O2.
(4) 2Al(OH)3 ![]() 2Al(OH)3.
2Al(OH)3.
(5) 2NaHCO3 ![]() Na2CO3 + H2O + CO2.
Na2CO3 + H2O + CO2.
Số phản ứng thuộc loại phản ứng oxi hóa - khử là:
Phản ứng oxi hóa - khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của nguyên tử trong phân tử.
Các phản ứng thuộc loại phản ứng oxi hóa khử là: (2); (3).
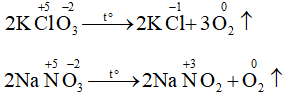
Các phản ứng không phải phản ứng oxi hóa - khử là: (1); (4); (5):
Hợp chất nào sau đây của lưu huỳnh vừa có tính oxi hóa vừa có tính khử?
Xác định số oxi hóa của lưu huỳnh trong các hợp chất:
Ta thấy, trong SO2, số oxi hóa của S là +4, có khả năng tăng lên +6, thể hiện tính khử, hay giảm xuống -2 thể hiện tính oxi hóa.
Hỗn hợp A gồm 2 kim loại Al, Zn trong đó số mol Al gấp đôi số mol Zn. Hòa tan hoàn toàn 11,9 gam hỗn hợp A trong dung dịch HCl dư thì thu được V lít khí H2 (đktc) và dung dịch X. Giá trị của V là bao nhiêu?
Gọi số mol của Al, Zn lần lượt là x, y
Phương trình phản ứng
2Al + 6HCl → 2AlCl3 + 3H2 (1)
x → 3x/2 mol
Zn + 2HCl → ZnCl2 +H2 (2)
y → y mol
Theo đề bài ta có:
x = 2y => x - 2y = 0 (3)
27x + 65y = 11,9 (4)
Giải hệ phương trình (3) và (4) ta có
x = 0,2 mol; y = 0,1 mol
Theo phương trình phản ứng
VH2 = 0,4.22,4 = 8,96 lít
Cho 2,6 gam bột kẽm vào 100 ml dung dịch CuCl2 0,75M. Lắc kĩ cho đến khi phản ứng kết thúc. Xác định tổng số mol của các chất trong dung dịch thu được.
nCuCl2 = 0,75.0,1 = 0,075 mol
Zn + CuCl2 → ZnCl2 + Cu
Trong dung dịch thu được ta có:
nZnCl2 = nZn = 0,04 mol
nCuCl2 dư = 0,075 - 0,04 = 0,035 mol
Tổng số mol của các chất trong dung dịch thu được: 0,04 + 0,035 = 0,075 mol
Cho sơ đồ phản ứng:
KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O
Hệ số (nguyên, tối giản) của chất oxi hóa, chất khử là
Số oxi hóa của các nguyên tố thay đổi:
Các quá trình nhường nhận electron:
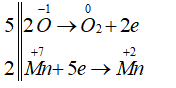
Vậy hệ số của KMnO4 là 2, hệ số của H2O2 là 5.
Xác định tổng hệ số cân bằng tối giản của các chất trong phản ứng dưới đây:
K2Cr2O7 + HCl ⟶ Cl2 + KCl + CrCl3 + H2O
Sự thay đổi số oxi hóa của các nguyên tố:
Quá trình oxi hóa và quá trình khử:
Áp dụng nguyên tắc: tổng số electron nhường bằng tổng số electron nhận
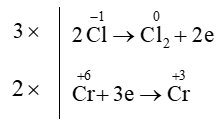
⇒ K2Cr2O7 + 14HCl ⟶ 3Cl2 + 2KCl + 2CrCl3 + 7H2O.
Vậy tổng hệ số cân bằng tối giản của các chất trong phản ứng là:
1 + 14 + 3 + 2 + 2 + 7 = 29
