Mỗi orbital nguyên tử được biểu diễn bằng
Mỗi orbital nguyên tử được biểu diễn bằng một ô vuông.
Mỗi orbital nguyên tử được biểu diễn bằng
Mỗi orbital nguyên tử được biểu diễn bằng một ô vuông.
Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
(b) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
(c) Các nguyên tố có cùng số electron hóa trị được xếp vào một nhóm.
(d) Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó.
Số nguyên tắc đúng là:
Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
- Các nguyên tố có cùng số electron hóa trị được xếp vào một nhóm.
Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng tuần hoàn là vị trí nào sau đây?
Thứ tự electron trong nguyên tử X 1s22s22p63s23p64s23d3
Cấu hình electron của nguyên tử R 1s22s22p63s23p64s23d34s2
Nguyên tử R có 23 electron. Vậy R thuộc ô số 23. R thuộc chu kì 4 nhóm VB
Phosphorus (P) là nguyên tố thuộc nhóm VA, chu kì 3 của bảng tuần hoàn. Cho các phát biểu sau:
(1) Nguyên tử P có 5 electron hóa trị và 8 electron p.
(2) Nguyên tử P có 3 lớp electron và có 2 electron độc thân.
(3) Công thức oxide cao nhất của P có dạng P2O5.
(4) Hydroxide cao nhất của P có dạng H3PO4 và có tính acid.
(5) Nguyên tố P có độ âm điện thấp hơn nguyên tố có số hiệu nguyên tử là 9.
Số phát biểu đúng là
1s22s22p63s23p3
(1) sai vì có 9 electron p
(2) sai vì có 3 electron độc thân
Nguyên tố có hiệu nguyên tử là 9 là nguyên tố F (F có giá trị độ âm điện lớn nhất trong các nguyên tố trong bảng tuần hoàn).
Vậy các phát biểu (3), (4), (5) đúng.
Lớp N là lớp thứ
Lớp N là lớp thứ 4
Một nguyên tử X có hai đồng vị có thành phần phần trăm lần lượt là 75,76% và 24,24%. Nguyên tử khối trung bình của X là 35,48. Tổng số hạt trong hai đồng vị là 106 và tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 30. Số neutron của đồng vị có số khối nhỏ hơn là
Ta có:
(1)
Tổng số hạt trong hai đồng vị là 106:
⇒ 2p + n1 + 2p + n2 = 106 (2)
Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 30:
⇒ 2p + 2p – n1 – n2 = 30 (3)
Từ (1), (2), (3) ⇒ p = 17, n1 = 18, n2 = 20
Nếu đường kính của nguyên tử là 102 pm thì đường kính của hạt nhân khoảng
Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10000 lần.
Nếu đường kính của nguyên tử là 102 pm thì đường kính của hạt nhân khoảng:
Hóa trị cao nhất đối với oxygen + hóa trị trong hợp chất với hydrogen = 8
Đối với X:
Hóa trị cao nhất đối với oxygen = hóa trị trong hợp chất khí đối với hydrogen = 4
X là carbon (C)
Đối với Y:
Hóa trị cao nhất đối với oxygen = 6; hóa trị trong hợp chất khí với hydrogen = 2
Y là lưu huỳnh (S)
- Oxide cao nhất của X là CO2 là chất khí ở điều kiện thường, SO3 là chất lỏng ở điều kiện thường sai.
- C thuộc chu kỳ 2, S thuộc chu kì 3 trong bảng tuần hoàn đúng.
- Nguyên tố Z cùng chu kì với X và cùng nhóm với Y Z là O
có độ âm điện lớn hơn X và Y
đúng.
- Hợp chất khí của Y với hydrogen là H2S:
đúng.
Số khối là
Số khối là tổng số proton (Z) và electron (N) trong một hạt nhân nguyên tử, kí hiệu là A.
A = Z + N
Cấu hình electron nào sau đây viết không đúng?
Cấu hình e viết sai là: 1s22s22p7 vì phân lớp p chứa tối đa 6 electron.
Trong bảng tuần hoàn các nguyên tố hóa học nguyên tố có tính kim loại mạnh nhất (trừ các nguyên tố có tính phóng xạ) là:
Nguyên tố có tính kim loại mạnh nhất (trừ các nguyên tố có tính phóng xạ) là kim loại ở cuối nhóm IA Cs.
Ở trạng thái cơ bản có bao nhiêu nguyên tố có cấu hình electron lớp ngoài cùng là 4s1?
Cấu hình e thoả mãn sẽ có dạng: 1s22s22p63s23p63dx4s1
Dễ thấy do lớp ngoài cùng là 4s1 nên x có 3 giá trị thoả mãn x = 0; 5; 10
Tương ứng với các cấu hình electron:
[Ar]4s1; [Ar]3d54s1; [Ar]3d104s1
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron của X và Y.
Gọi số hạt proton, neutron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’
Theo bài: P = N = E và P’ = N’ = E’
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
(1)
Tổng số proton trong phân tử XY2 là 32
P + 2P’ = 32 (2)
Từ (1) và (2) tìm được: P = 16 (S) và P’ = 8 (O)
Hợp chất cần tìm là SO2
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4.
Nguyên tử nào sau đây có 8 electron ở lớp ngoài cùng?
Nguyên tử Y có 18 electron ở vỏ nguyên tử, vậy số electron ở mỗi lớp là: 2/8/8.
Khối lượng của fluorine (F) theo amu là 19,1608. Khối lượng fluorine theo đơn vị kg là
1 amu = 1,66.10-24 g = 1,66.10-27 kg
Khối lượng của fluorine (F) theo amu là 19,1608
Khối lượng của F theo kg là: mF = 19,1608.1,66.10-27= 31,807.10-27 (kg)
Một nguyên tố X thuộc chu kì 3 có số electron s bằng số electron p. X ở cùng nhóm với nguyên tố nào sau đây?
Nguyên tố X ở chu kì 3 có số electron s bằng số electron p
X có 6 electron s có 6 electron p
Vậy cấu hình electron của X là 1s22s22p63s2
X ở trong nhóm IIA, cùng nhóm với 38R.
Hợp chất với hydrogen của nguyên tố có công thức XH3. Biết % về khối lượng của oxygen trong oxide cao nhất của X là 56,34%. Nguyên tử khối của X là :
Hợp chất khí với hydrogen của X là XH3 nên X thuộc nhóm VA.
Công thức oxide cao nhất là X2O5.
Trong oxide mà X có hóa trị cao nhất chiểm 56,34% vè khối lượng nên:
X = 31
Cho các nguyên tố: A (Z = 14), B (Z = 6), C (Z = 7). Độ âm điện (![]() ) của nguyên tử các nguyên tố sắp xếp theo tứ tự nào sau đây là đúng?
) của nguyên tử các nguyên tố sắp xếp theo tứ tự nào sau đây là đúng?
Ta có cấu hình electron của các nguyên tử:
Z = 14: 1s22s22p63s23p2
Z = 6: 1s22s22p2
Z = 7: 1s22s22p3.
A và B thuộc cùng 1 nhóm
A <
B
B và C thuộc cùng 1 chu kì
B <
D
Trong tự nhiên, argon có các đồng vị 40Ar, 38Ar, 36Ar chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Nguyên tử khối trung bình của Ar gần nhất với đáp án là
Phần trăm số nguyên tử 36Ar là: 100% - 99,604% - 0,063% = 0,333%.
Nguyên tử khối trung bình của Ar là:
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
Cấu hình electron của Na (Z = 11): 1s22s22p63s1
Hòa tan hoàn toàn 2 gam hỗn hợp hai kim loại kiềm thổ A, B (MA < MB) thuộc hai chu kì liên tiếp vào dung dịch HCl dư thu được 1,7353 lít khí (đkc). Phần trăm khối lượng A trong hỗn hợp kim loại là
Gọi công thức chung của kim loại là R R hóa trị II (kim loại kiềm thổ)
R + 2HCl RCl2 + H2
Ta có:
nH2 = = 0,07 mol
nR = nH2 = 0,07 mol
MR =
= 28,57
2 kim loại là Mg và Ca
Gọi số mol Mg là x, Ca là y, ta có hệ:
Phát biểu nào sau đây là sai?
Trong nguyên tử, electron chuyển động rất nhanh và không theo quỹ đạo xác định.
Thứ tự các bước trong phương pháp nghiên cứu hóa học là
Thứ tự các bước trong phương pháp nghiên cứu hóa học là: (1) xác định vấn đề nghiên cứu; (2) nêu giả thuyết khoa học; (3) thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng); viết báo cáo: thảo luận kết quả và kết luận vấn đề.
Tổng số electron tối đa chứa trong phân lớp p là
Trong 1 orbital chỉ chứa tối đa 2 electron.
Phân lớp s có 1 AO → Số electron tối đa trong phân lớp s là: 1×2 = 2.
Phân lớp p có 3 AO → Số electron tối đa trong phân lớp p là: 3×2 = 6.
Phân lớp d có 5 AO → Số electron tối đa trong phân lớp d là: 5×2 = 10.
Phân lớp f có 7 AO →Số electron tối đa trong phân lớp f là: 7×2 = 14.
Đối tượng nghiên cứu của hóa học là
Đối tượng nghiên cứu của hóa học là chất và sự biến đổi của chất.
Dãy các phân lớp nào sau đây đã bão hòa electron?
Phân lớp electron bão hòa là phân lớp có số electron được điền tối đa:
Phân lớp s: có tối đa 2 electron
Phân lớp p: có tối đa 6 electron
Phân lớp d: có tối đa 10 electron
Phân lớp f: có tối đa 14 electron
Như vậy, dãy s2, p6, d10, f14 là các phân lớp electron đã bão hòa.
Hãy cho biết các hoạt động trong hình tương ứng với phương pháp học tập hóa học nào.

Các hoạt động trong hình tương ứng với phương pháp học tập thông qua thực hành thí nghiệm.
Thông tin nào sau đây không đúng?
Thông tin không đúng: Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu.
Vì electron mang điện tích âm, chuyển động xung quanh hạt nhân nguyên tử và có khối lượng sấp xỉ bằng 0,00055 amu.
Hạt nhân của ion X có điện tích là 30,45.10-19 C (biết điện tích của 1 proton là 1,602.10-19). Vậy nguyên tử đó là
Hạt nhân của ion X có điện tích là 30,45.10-19 C
X là K.
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần là:
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần: C, N, O, F vì 4 nguyên tố này cùng thuộc 1 chu kì và cùng sắp xếp theo chiều tăng điện tích hạt nhân.
Orbital nguyên tử là gì?
Orbital nguyên tử là khu vực không gian xung quanh nguyên tử mà tại đó xác suất tìm thấy electron lớn nhất (khoảng 90%).
Dãy gồm các oxide có tính acid tăng dần là:
Ta có:
| Nhóm | VA | VIA | VIIA | |
| Oxide | Chu kì 3 | P2O5 | SO3 | Cl2O7 |
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide tương ứng của chúng tăng dần.
So sánh tính acid: P2O5, SO3, Cl2O7.
Nguyên tử của nguyên tố nào trong nhóm VA có bán kính nguyên tử lớn nhất?
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Dãy gồm các nguyên tử cấu hình electron lớp ngoài có cùng dạng ...ns2np6 là
Dãy gồm các nguyên tử cấu hình electron lớp ngoài có cùng dạng ...ns2np6 là các nguyên tử nguyên tố thuộc nhóm VIIIA.
⇒ Nguyên tử thỏa mãn: Ne, Ar.
Dữ kiện nào trong kết quả thí nghiệm của nhà vật lí người Anh J.J. Thomson chứng minh các electron mang điện tích âm?
Năm 1897, nhà vật lí người Anh J.J. Thom son thực hiện thí nghiệm phóng điện trong ống thủy tinh gần như chân không. Ông quan sát thấy màn huỳnh quang trong ống phát sáng do những tia phát ra từ cực âm và những tia này bị hút về cực dương của trường điện, chứng tỏ chúng tích điện âm. Đó chính là chùm hạt electron.
Một nguyên tử có 3 lớp electron, trong đó số electron p bằng số electron s. Số electron ở lớp ngoài cùng của nguyên tử này là
Nguyên tử có 3 lớp electron Số electron s tối đa là 6.
Vì nguyên tử có 3 lớp electron, số electron p nhỏ nhất là 6 (6 electron trên phân lớp 2p, phân lớp 3p không có electron).
Vậy số electron s = số electron p = 6.
Do đó tại lớp ngoài cùng có 2 electron s và không có electron p.
Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
Ta có: ZM = (79 + 19 + 2.3):4 = 26
M là iron (Fe).
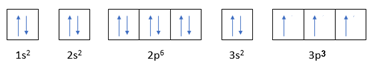
Biễu diễn electron vào AO ở lớp vỏ ngoài cùng của một nguyên tử nguyên tố X có dạng sau đây:
![]()
3s2
X là nguyên tử nguyên tố nào sau đây?
Cấu hình electron của X là: 1s22s22p63s2
ZX = 12
Vậy X là magnesium.
Phát biểu nào sau đây không đúng?
Các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
Phân bố electron trên các lớp K/L/M/N của nguyên tố arsenic lần lượt là 2/8/18/5. Phát biểu nào sau đây là sai?
Theo bài ra ta có cấu hình electron của arsenic là: 1s22s22p63s23p63d104s24p3
- Lớp ngoài cùng của arsenic có 2 electron s.
- Điện tích hạt nhân arsenic là 33+.
- Tổng số electron p của nguyên tử arsenic là: 6 + 6 + 3 = 15
- Tổng số electron d của nguyên tử arsenic là: 10.
