Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài học: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng đã giới thiệu cho các em lý thuyết tốc độ phản ứng và biểu thức tốc độ phản ứng. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Chân trời sáng tạo
I. Tốc độ phản ứng
1. Khái niệm tốc độ phản ứng hóa học
- Khái niệm tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Kí hiệu: ν .
Đơn vị: (Đơn vị nồng độ)/(đơn vị thời gian)
- Theo thời gian, nồng độ các chất phản ứng và sản phẩm thay đổi nên tốc độ phản ứng sẽ thay đổi, vì vậy người ta sử dụng tới đại lượng tốc độ phản ứng trung bình.
- Tốc độ tức thời của phản ứng, là tốc độ phản ứng tại một thời điểm nào đó.
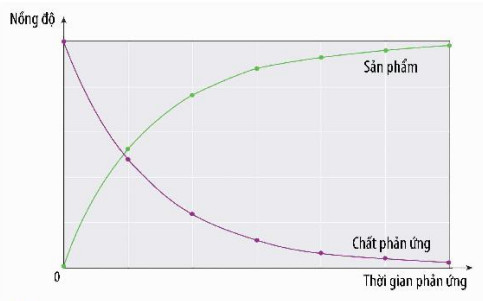
Hình 1. Đồ thị biểu diễn sự thay đổi nồng độ chất phản ứng nồng độ của chất phản ứng và (màu tím) và sản phẩm (màu xanh) theo thời gian
2.Tính tốc độ trung bình của phản ứng hoá học
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát:
aA + bB → bC + dD
Biểu thức tốc độ trung bình của phản ứng:
![]()
Trong đó:
![]() : tốc độ trung bình của phản ứng
: tốc độ trung bình của phản ứng
![]() : sự biến thiên nồng độ
: sự biến thiên nồng độ
![]() : biến thiên thời gian
: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2.
Ví dụ: Cho phản ứng hóa học:
![]()
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30M lên 0,40M. Tính tốc độ trung bình của phản ứng.
Hướng dẫn giải:
Biến thiên thời gian phản ứng: ![]() t = t2 - t1 = 120 − 61 = 59 (s)
t = t2 - t1 = 120 − 61 = 59 (s)
Biến thiên nồng độ của NO2 trong phản ứng: ![]() CNO2 = 0,40 – 0,30 = 0,10 (M)
CNO2 = 0,40 – 0,30 = 0,10 (M)
Tốc độ trung bình của phản ứng là:
![]()
II. Biểu thức tốc độ phản ứng
- Các phản ứng diễn ra với tốc độ khác nhau tùy thuộc vào nhiều yếu tố: nồng độ, nhiệt độ, áp suất đối với chất tham gia là chất khí, bề mặt tiếp xúc, chất xúc tác, cường độ ánh sáng, thể của chất, dung môi hòa tan các chất phản ứng, ...
- Năm 1864, hai nhà bác học Guldberg (Gấu-bớc) và Waage (Qua-ge) khi nghiên cứu sự phụ thuộc của tốc độ vào nồng độ đã đưa ra định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
Phản ứng đơn giản có dạng:
aA+ bB → cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức: ![]()
Trong đó:
k là hằng số tốc độ phản ứng.
CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét.
Chú ý:
- Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì k = v, vậy k là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng.
- Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ.
Ví dụ: Cho phản ứng đơn giản xảy ra trong bình kín:
2NO(g) + O2 → 2NO2(g)
Viết biểu thức tốc độ tức thời của phản ứng.
Hướng dẫn giải:
Biểu thức tốc độ tức thời của phản ứng trên là:
![]()
-
Chương 1. Cấu tạo nguyên tử
-
Chương 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chương 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chương 4. Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6. Tốc độ phản ứng hóa học
-
Chương 7. Nguyên tố nhóm VIIA - Halogen
-
Đề thi cuối học kì 2







