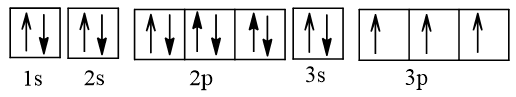
Độ âm điện của các nguyên tố Mg, Al, B và N xếp theo chiều tăng dần là
Theo chiều tăng dần của điện tích hạt nhân:
Trong một chu kì, độ âm điện tăng.
Trong một nhóm, độ âm điện giảm.
Mg và Al cùng thuộc một chu kì ⇒ Độ âm điện: Mg < Al
Al và B cùng thuộc một nhóm ⇒ Độ âm điện: Al < B
⇒ Độ âm điện Mg < Al < B (1)
Lại có N và B cùng thuộc một chu kì ⇒ Độ âm điện B < N (2)
Kết hợp (1) và (2). Độ âm điện của các nguyên tố xếp theo chiều tăng dần là:
Mg < Al < B < N.