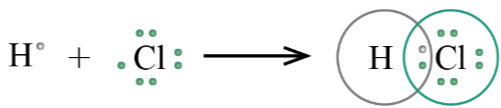
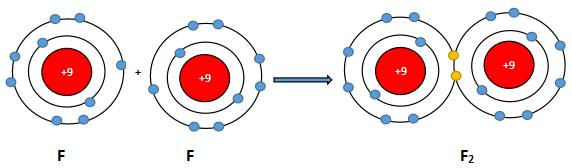
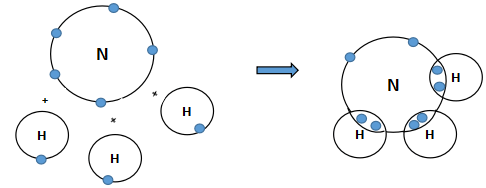
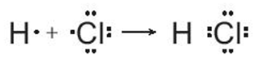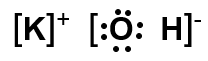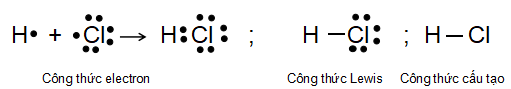Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực? Biết độ âm điện của các nguyên tố Na, O, H, C lần lượt là 0,93; 3,44; 2,20; 2,55.
Hướng dẫn:
Liên kết Na – O có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là:
3,44 - 0,93 = 2,51 > 1,7 ⇒ Liên kết ion.
Liên kết O – H có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là:
3,44 - 2,96 = 0,48 > 4 là liên kết cộng hóa trị phân cực.
Liên kết Na – C có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là:
2,55 - 0,93 = 1,62 < 1,7 là liên kết cộng hóa trị phân cực.
Liên kết C – H có hiệu độ âm điện giữa hai nguyên tử tham gia liên kết là
(2,55 – 2,20) = 0,35 < 0,4 ⇒ là liên kết cộng hóa trị không phân cực.