Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Định luật tuần hoàn
Tìm hiểu sự biến đổi cấu hình electron nguyên tử của các nguyên tố nhóm A và định luật tuần hoàn
Bảng: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
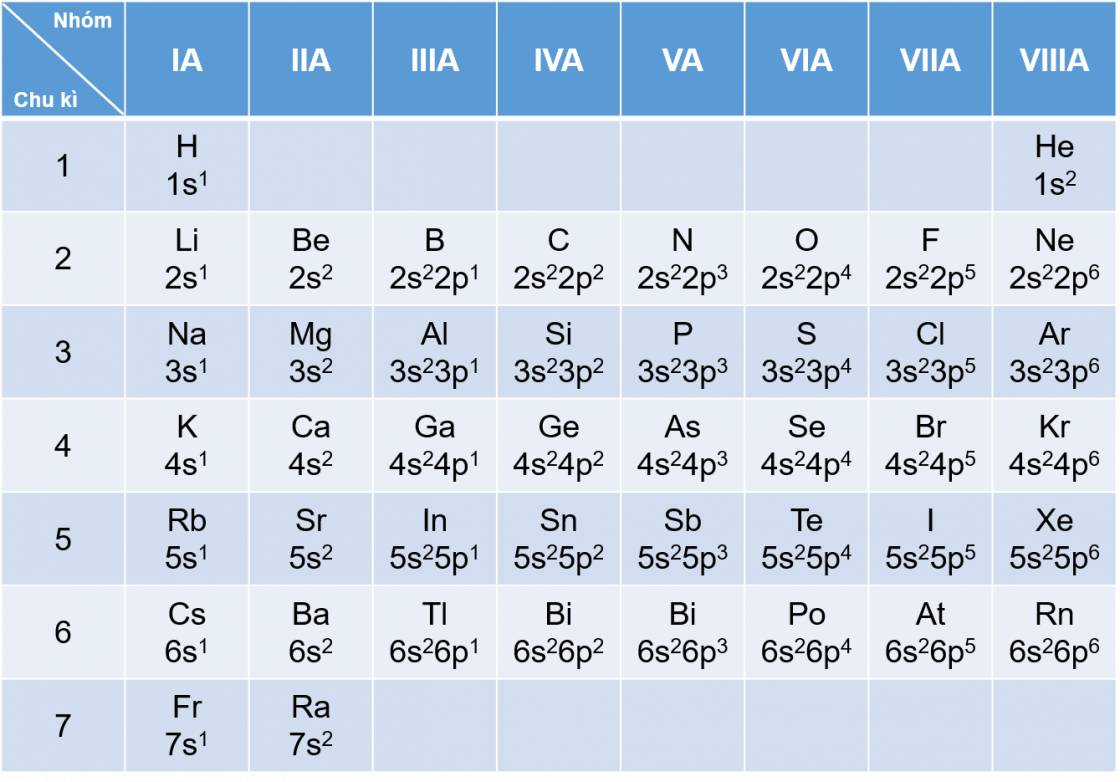
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố, cũng như hợp chất của chúng.
II. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Trình bày mối quan hệ giữa cấu hình electron, vị trí và tính chất của các nguyên tố trong bảng tuần hoàn
Hướng dẫn trả lời câu hỏi
|
Cấu tạo nguyên tử Ca
|
  |
Vị trí nguyên tố Ca
|
|
Tính chất nguyên tố Ca
|
||
Mối quan hệ vị trí, cấu hình electron và tính chất của Calcium
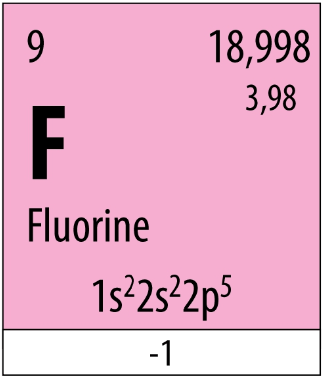
Fluorine được sử dụng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa. Fluorine (F) là một nguyên tố hóa học có số hiệu nguyên tử bằng 9, thuộc chu kì 2, nhóm VIIA. Từ vị trí của fluorine trong bảng tuần hoàn, có thể dự đoán được tính chất hóa học cơ bản của fluorine không? Khả năng phản ứng của fluorine như thế nào?
Hướng dẫn giải
Fluorine thuộc chu kì 2, nhóm VIIA
→ Có 7 electron ở lớp ngoài cùng
→ Có xu hướng nhận thêm 1 electron tạo thành F- có cấu hình electron bền vững
→ Fluorine có tính phi kim, tính oxi hóa mạnh và có khả năng phản ứng mãnh liệt vì có độ âm điện lớn
Ví dụ 2: Dựa vào vị trí của nguyên tố Mg (Z = 12) trong bảng tuần hoàn.
a) Hãy nêu các tính chất sau của nguyên tố:
- Tính kim loại hay tính phi kim.
- Hóa trị cao nhất trong hợp chất với oxi.
- Công thức của oxit cao nhất, của hiđroxit tương ứng và tính chất của nó.
b) So sánh tính chất hóa học của nguyên tố Mg (Z = 12) với Na (Z = 11) và Al (Z = 13).
Hướng dẫn giải
a) Cấu hình electron của nguyên tử Mg: 1s22s22p63s2.
Mg có 2e ở lớp ngoài cùng nên thể hiện tính kim loại, hóa trị cao nhất với oxi là II, chất MgO là oxit bazơ và Mg(OH)2 là bazơ.
b) Na:1s22s22p63s1.
Mg: 1s22s22p63s2
Al: 1s22s22p63s23p1
- Có 1, 2, 3 electron ở lớp ngoài cùng nên đều là kim loại.
- Tính kim loại giảm dần theo chiều Na, Mg, Al.
- Tính bazơ giảm dần theo chiều NaOH, Mg(OH)2, Al(OH)3.
Nội dung cùng chủ đề
-
Chương 1. Cấu tạo nguyên tử
-
Chương 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chương 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chương 4. Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6. Tốc độ phản ứng hóa học
-
Chương 7. Nguyên tố nhóm VIIA - Halogen
-
Đề thi cuối học kì 2







