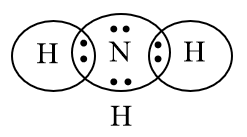
Nguyên tử của nguyên tố nitrogen có Z = 7. Hydroxide cao nhất của nguyên tố này có
Cấu hình electron của nguyên tử nguyên tố nitrogen (N):1s22s22p3
→ Nguyên tố N nằm ở ô 7, chu kì 2, nhóm VA của bảng tuần hoàn.
→ Hóa trị cao nhất của nguyên tố N là V.
→ Công thức hydroxide của N là HNO3 (có tính acid mạnh).