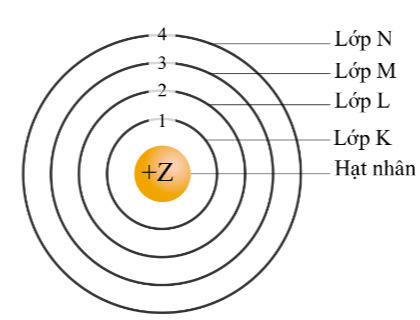
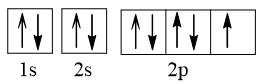
Sự chuyển động của electron theo quan điểm hiện đại được mô tả:
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (khoảng 90%).