Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài học: Tính chất vật lí và hóa học các đơn chất nhóm VIIA đã giới thiệu cho các em lí thuyết về vị trí, trạng thái tự nhiên, cấu hình electron, tính chất vật lí, hóa học và ứng dụng các halogen. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Chân trời sáng tạo
I. Vị trí của nhóm halogen trong bảng tuần hoàn
Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
Trong đó astatine (At) và tennessine (Ts) là các nguyên tố phóng xạ.
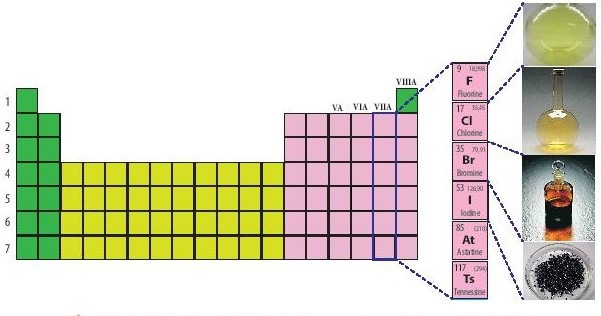 Hình 1: Vị trí nhóm halogen trong bảng tuần hoàn
Hình 1: Vị trí nhóm halogen trong bảng tuần hoàn
II. Trạng thái tự nhiên của các halogen
Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-).
- Ion F-: Được tìm thấy trong khoáng chất như fluorite (CaF2); fluorapatite (Ca5(PO4)3F) và cryolite (Na3AlF6).
- Ion Cl-: Có nhiều trong nước biển, trong quặng halite (NaCl, thường gọi là muối mỏ), sylvite (KCl).
- Ion Br-: Có trong quặng bromargyrite (AgBr), cũng có trong nước biển và các mỏ muối.
- Ion I-: Có trong iodargyrite (AgI)... cũng có trong nước biển và các mỏ muối.
 Hình 2: Một số khoáng chất chứa ion halide
Hình 2: Một số khoáng chất chứa ion halide
III. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. Đặc điểm cấu tạo phân tử halogen
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron: phân lớp s có 2 electron, phân lớp p có 5 electron. Do đó, để đạt cấu hình electron bền vững giống khí hiếm, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử.
Ví dụ:

- Công thức cấu tạo của phân tử halogen: X – X.
Kết luận: Đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hóa trị không phân cực.
IV. Tính chất vật lý của các halogen
Các halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4), …
Từ fluorine đến iodine:
- Trạng thái tập hợp của đơn chất ở 20oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
- Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi tăng.
V. Tính chất hoá học của các halogen
Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng:
X + 1e → X-
1. Tác dụng với kim loại
Các halogen phản ứng với kim loại thể hiện các mức độ khác nhau:
- Fluorine tác dụng được với tất các các kim loại.
Ví dụ:
2Ag + F2 → 2AgF
- Chlorine tác dụng với hầu hết các kim loại (trừ Au, Pt).
Ví dụ:
2Fe + 3Cl2 → 2FeCl3
- Bromine phản ứng với nhiều kim loại, nhưng khả năng phản ứng yếu so với fluorine và chlorine.
Ví dụ:
2Na + Br2 → 2NaBr
- Iodine phản ứng với kim loại yếu hơn so với bromine, chlorine và fluorine.
Ví dụ:
2Al + 3I2 ![]() 2AlI3
2AlI3
 Hình 3: Thí nghiệm halogen phản ứng với kim loại
Hình 3: Thí nghiệm halogen phản ứng với kim loại
2. Tác dụng với hydrogen
Các halogen phản ứng với hydrogen, tạo thành hydrogen halide:

3. Tác dụng với dung dịch kiềm
Halogen tác dụng với dung dịch kiềm, sản phẩm tạo thành phụ thuộc vào nhiệt độ phản ứng.
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH ![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
Dung dịch hỗn hợp NaCl và NaClO được gọi là nước Javel, có tính oxi hóa mạnh nên được dùng làm chất tẩy màu và sát trùng.

4. Tác dụng với dung dịch muối halide
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
5. Tính tẩy màu của khí chlorine ẩm
Phương trình hoá học điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
VI. Ứng dụng của các halogen
- Fluorine: Được dùng trong sản xuất các chất dẻo ma sát thấp, như teflon phủ trên chảo chống dính… Một số hợp chất khác của fluorine như cryolite dùng cho sản xuất nhôm; sodium fluorine sử dụng như một loại thuốc trừ sâu, chống gián; một số muối fluorine khác được thêm vào thuốc đánh răng, tạo men răng, …

Ứng dụng của fluorine trong sản xuất kem đánh răng
- Chlorine: Là chất oxi hóa mạnh, được sử dụng làm chất tẩy trắng và khử trùng nước. Một lượng lớn chlorine được dùng để sản xuất các dung môi như carbon tetrachloride (CCl4), chloroform (CHCl3), 1,2-dichloroethylene (C2H2Cl2) …
 Ứng dụng của chlorine trong sản xuất dung môi hữu cơ
Ứng dụng của chlorine trong sản xuất dung môi hữu cơ
- Bromine: Được dùng để điều chế thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in; silver bromide (AgBr) là chất nhạy với ánh sáng, dùng để tráng phim ảnh, phụ gia chống ăn mòn cho xăng, …
 Ứng dụng bromine trong sản xuất phim cuộn
Ứng dụng bromine trong sản xuất phim cuộn
- Iodine: Là nguyên tố vi lượng cần thiết cho dinh dưỡng của con người, thiếu iodine có thể gây nên tác hại cho sức khỏe như gây bệnh bướu cổ, thiểu năng trí tuệ, hỗn hợp ethanol và iodine là chất sát trùng phổ biến. Các hợp chất iodine được sử dụng làm chất xúc tác, dược phẩm và thuốc nhuộm.







