Tính biến thiên Enthalpy của phản ứng hóa học
Bài học: Tính biến thiên Enthalpy của phản ứng hóa học đã giới thiệu cho các em cách xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết và dựa vào enthalpy tạo thành. Bên cạnh là các ví dụ và bài tập có lời giải chi tiết, xây dựng dựa trên kiến thức trọng tâm chương trình hóa 10 Chân trời sáng tạo
I. Xác định biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết
Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
Cho phản ứng tổng quát ở điều kiện chuẩn:
aA(g) + bB(g) → mM(g) + nN(g)
Tính ![]() của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
![]() = a x Eb(A) + b x Eb(B) – m x Eb(M) - n x Eb(N)
= a x Eb(A) + b x Eb(B) – m x Eb(M) - n x Eb(N)
Điều kiện áp dụng: Áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
Tổng quát:
![]() =
= ![]() Eb(cđ) −
Eb(cđ) − ![]() Eb(sp)
Eb(sp)
Trong đó:
![]() Eb(cđ) là tổng năng lượng liên kết trong phân tử chất đầu.
Eb(cđ) là tổng năng lượng liên kết trong phân tử chất đầu.
![]() Eb(sp) là tổng năng lượng liên kết trong phân tử sản phẩm.
Eb(sp) là tổng năng lượng liên kết trong phân tử sản phẩm.
Ví dụ: Tính ![]() của phản ứng N2H4(g) → N2(g) + 2H2(g) biết:
của phản ứng N2H4(g) → N2(g) + 2H2(g) biết:
E(N - H) = 391 kJ/mol; E(N ≡N) = 945 kJ/mol; E(H - H) = 432 kJ/mol; E(N - N) = 160 kJ/mol.
Hướng dẫn giải:
N2H4(g) → N2(g) + 2H2(g)
Cấu tạo phân tử N2H4:
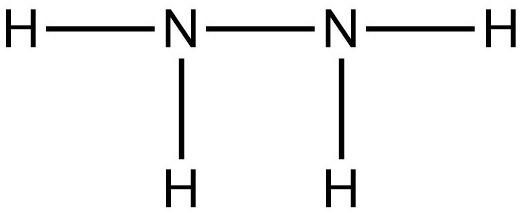
Ta có:
![]() =
= ![]() Eb(cđ) −
Eb(cđ) − ![]() Eb(sp)
Eb(sp)
= 1x (1xEN - N) + 4xE(N - H)) - (1x E(N≡N) + 2xE(H - H))
= 1x160 + 4x391 - (945 + 2x432)
= -85 kJ.
II. Xác định biến thiên Enthalpy của phản ứng dựa vào Enthalpy
Cho phương trình hoá học tổng quát:
aA + bB → MM + nN
Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hoá học ![]() khi biết các giá trị
khi biết các giá trị ![]() của tất cả các chất đầu và sản phẩm theo công thức sau:
của tất cả các chất đầu và sản phẩm theo công thức sau:
![]()
Tổng quát:
![]()
Trong đó:
![]()
![]() (sp) là tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm.
(sp) là tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm.
![]()
![]() (cđ) là tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của chất đầu.
(cđ) là tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của chất đầu.
Ví dụ: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(g)
3CO2(g) + 4H2O(g)
Tính ![]() của dựa vào nhiệt tạo thành của hợp chất, biết:
của dựa vào nhiệt tạo thành của hợp chất, biết:
![]() (C3H8(g)) = -105,00 kJ/mol;
(C3H8(g)) = -105,00 kJ/mol; ![]() (CO2(g)) = -393,50 kJ/mol;
(CO2(g)) = -393,50 kJ/mol; ![]() (H2O(g)) = -241,82 kJ/mol.
(H2O(g)) = -241,82 kJ/mol.
Hướng dẫn giải:
![]() =
= ![]()
![]() (sp) -
(sp) - ![]()
![]() (cđ)
(cđ)
= 3![]()
![]() (CO2(g)) + 2
(CO2(g)) + 2![]()
![]() (H2O(g)) - 1
(H2O(g)) - 1![]()
![]() (C3H8(g)) - 5
(C3H8(g)) - 5![]()
![]() (O2(g))
(O2(g))
= 3x(-393,50) + 2x(-241,82) - 1x(-105,00) - 5x0
= -1559,14 kJ.
-
Chương 1. Cấu tạo nguyên tử
-
Chương 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chương 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chương 4. Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6. Tốc độ phản ứng hóa học
-
Chương 7. Nguyên tố nhóm VIIA - Halogen
-
Đề thi cuối học kì 2







