Liên kết cộng hóa trị
I. Sự hình thành liên kết cộng hóa trị
1. Sự hình thành liên kết trong các phân tử hydrogen chloride, oxygen và nitrogen
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung
Ví dụ 1:
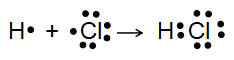
Sự hình thành liên kết trong phân tử HCl
Giữa nguyên tử hydrogen và nguyên tử chlorine trong phân tử HCl có một cặp electron chung, được biểu diễn bằng một gạch nối “-”, đó là liên kết đơn. Do đó liên kết trong phân tử HCl được biểu diễn là H-Cl.
Ví dụ 2:
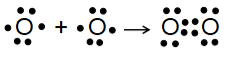
Sự hình thành liên kết trong phân tử O2
Giữa hai nguyên tử oxygen trong phần tử O, có hai cặp electron chung, được biểu diễn bằng hai gạch nối “=”, đó là liên kết đôi. Do đó liên kết trong phân tử O, được biểu diễn là O=O.
Ví dụ 3:
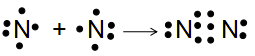
Sự hình thành liên kết trong phân tử N2
Giữa hai nguyên tử nitrogen trong phân tử N, có ba cặp electron chung, được biểu diễn bằng ba gạch nối “≡”, đó là liên kết ba. Do đó liên kết trong phân tử N, được biểu diễn là ![]()
Các công thức H-Cl, O=O và N≡N gọi là công thức cấu tạo của HCl, O2 và N2.
Liên kết đơn là liên kết được tạo bởi 1 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng một gạch nối “–”
Liên kết đôi là liên kết được tạo bởi 2 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng hai gạch nối “=”
Liên kết ba là liên kết được tạo bởi 3 cặp electron dùng chung giữa hai nguyên tử, biểu diễn bằng ba gạch nối “≡”
2. Cách viết công thức Lewis
Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phần tử. Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối"-".
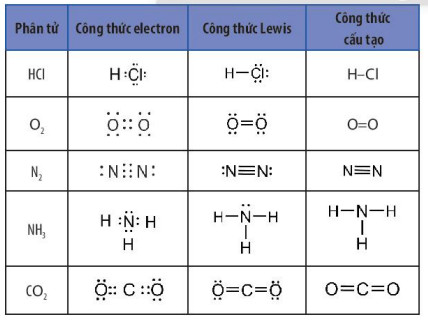
Công thức electron, công thức Lewis và công thức cấu tạo của một số phân tử
Liên kết cộng hóa trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
II. Liên kết cho - nhận
1. Khái niệm về liên kết cho – nhận
Trong trường hợp cặp electron chung giữa hai nguyên tử tham gia liên kết chỉ do một nguyên tử đóng góp thì liên kết cộng hoá trị giữa hai nguyên tử là liên kết cho – nhận.
Ví dụ: Sự hình thành liên kết cho - nhận trong ion ammonium
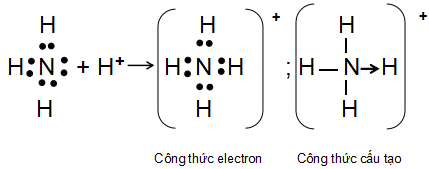
Sơ đồ tạo liên kết cho nhận trong ion NH4+
- Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa tham gia liên kết, ion H+ có orbital trống, không chứa electron. Khi cho NH3 kết hợp với ion H+, nguyên tử N sử dụng một cặp electron chưa liên kết làm cặp electron chung với ion H+ tạo thành ion NH4+.
- Nguyên tử N đóng góp cặp electron chung nên là nguyên tử cho.
- Ion H+ không đóng góp electron, đóng vai trò nhận electron.
Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hoá trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
III. Phân biệt các loại liên kết dựa theo độ âm điện
1. Phân biệt liên kết cộng hoá trị phân cực và không phân cực
Ta đã biết độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tham gia hình thành các liên kết hoá học.
Quan sát công thức electron của các phân tử dưới đây, các cặp electron chung trong các phần tử O2, và N2 không lệch về phía nguyên tử nào, trong khi với các phân tử HCl, NH3 và CO2 cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.

Liên kết cộng hoá trị trong các phân tử O2, N2 là liên kết cộng hóa trị không phân cực, trong khi các phân tử HCl, NH3 và CO2 là liên kết cộng hóa trị phân cực.
Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
Liên kết cộng hóa trị phân cực là liên kết cộng hoá trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
2. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
Có thể dựa vào hiệu độ âm điện ![]() giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng theo Bảng 10.2.
giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng theo Bảng 10.2.
| Hiệu độ âm điện (△ |
Loại liên kết |
| 0 ≤ |△ |
Cộng hóa trị không phân cực |
| 0,4 ≤ |△ |
Cộng hóa trị phân cực |
| |△ |
Ion |
Hiệu độ âm điện và loại liên kết tương ứng
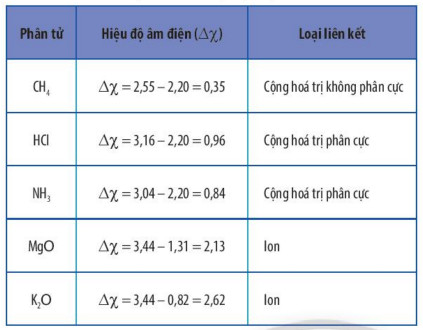
Hiệu độ âm điện và loại liên kết trong một số phân tử
Ví dụ 1: Xác định loại liên kết trong các phân tử sau
- Trong phân tử MgCl2
Hiệu độ âm điện của Cl và Mg là: 3,16 - 1,31 = 1,85 > 1,7
⇒ Liên kết Mg-Cl trong phân tử MgCl2 là liên kết ion.
- Trong phân tử C2H4
Hiệu độ âm điện của C và H là: 2,55 - 2,2 = 0,35
⇒ Liên kết C-H trong phân tử C2H4 là liên kết cộng hóa trị không phân cực.
Ví dụ 2: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
IV. Sự hình thành liên kết σ , π và năng lượng liên kết
1. Tìm hiểu sự hình thành liên kết σ và liên kết π
Liên kết cộng hoá trị được hình thành khi các orbital nguyên tử của hai nguyên tố xen phủ lẫn nhau. Sự xen phủ này có thể xảy ra theo hai cách là xen phủ trục và xen phủ bên, hình thành nên hai loại liên kết cộng hoá trị tương ứng là liên kết σ và liên kết π.

Sự xen phủ giữa hai orbital 1s của hai nguyên tử hydrogen hình thành liên kết σ trong phân tử hydrogen
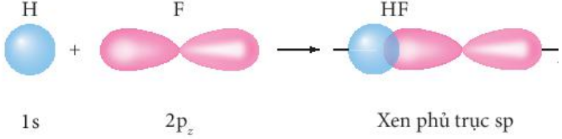
Sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 2p của nguyên tử fluorine hình thành liên kết σ trong phân tử hydrogen fluoride

Sự xen phủ giữa orbital 2p của nguyên tử fluorine hình thành liên kết σ trong phân tử fluorine
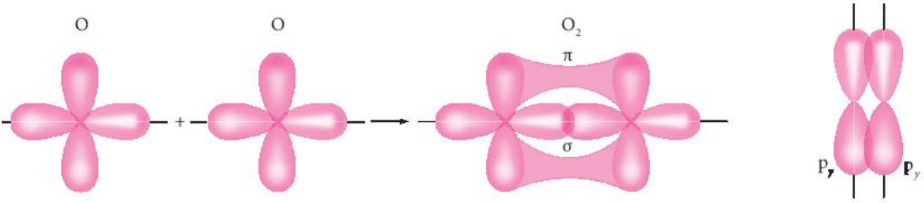
Sự xen phủ các AO hình thành liên kết σ và liên kếtπ trong phân tử oxygen
Liên kết σ là loại liên kết cộng hoá trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
Liên kết π là loại liên kết cộng hoá trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ năm hai bên đường nội tâm hai nguyên tử.
2. Khái niệm năng lượng liên kết (Eb)
Cho các phương trình phản ứng sau:
H2 (g) → 2H (g) Eb = 432 kJ/mol (1)
N2 (g) → 2N (g) Eb = 945 kJ/mol (2)
Ta nói năng lượng liên kết Eb trong phân tử H2 và N2 lần lượt là 432 kJ/mol và 945 kJ/mol. Điều này có nghĩa cân cung cấp 432 kg và 945 kg để lần lượt phá vỡ 1 mol khí H2 và 1 mol khí N2 thành các nguyên tử ở thể khí.
Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
Đối với các phần tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ hoàn toàn 1 mol phân tử đó ở thể khi thành các nguyên tử thể khí.
Ví dụ: Tổng năng lượng liên kết trong phân tử CH4 là 1 660 kJ/mol.
CH4 (g) → C (g) + 4H (g) Eb = 1 660 kJ/mol
Do đó, năng lượng liên kết trung bình của một liên kết C-H là 1660 : 4 = 415 kJ/mol.
Năng lượng của một liên kết hoá học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí.
Giá trị năng lượng của một liên kết hoá học là thước đo độ bền liên kết.







