Quy tắc Octet
1. Liên kết hóa học
Phần tử được tạo nên từ các nguyên tử bằng các liên kết hoá học.
Ví dụ:
Phân tử hydrogen (H2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử hydrogen (H).
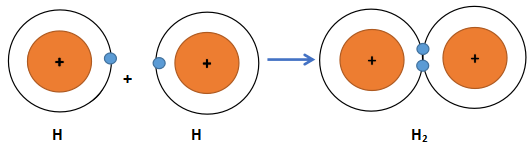
Sự hình thành các phân tử hydrogen
Phân tử fluorine (F2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử fluorine (F)
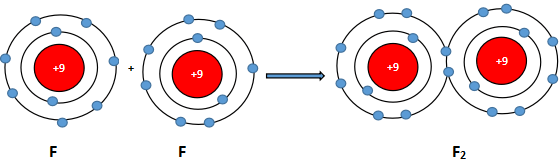
Sự hình thành các phân tử flurione
II. Quy tắc Octet
1. Vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
Để đạt cấu hình electron bền vững của các khí hiếm gần nhất, nguyên tử của các nguyên tố có xu hướng nhường hoặc nhận thêm, hoặc góp chung các electron hoá trị với các nguyên tử khác khi tham gia liên kết hóa học.
Ví dụ 1: Liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử nitrogen đã góp chung 3 electron hoá trị, tạo nên 3 cặp electron chung như hình.
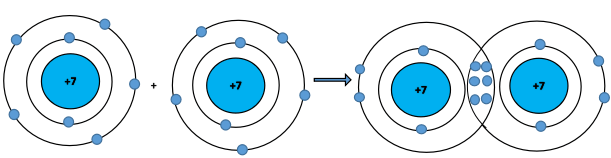
Sự hình thành liên kết trong phân tử nitrogen
2. Vận dụng quy tắc Octet trong sự hình thành ion dương, ion âm
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron này, nguyên tử sodium sẽ đạt được cấu hình electron bền vững sau:
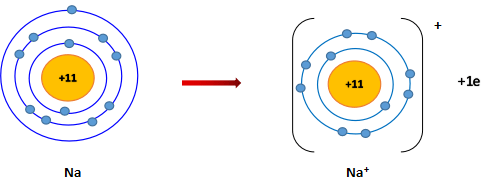
Nguyên tử sodium (Na) lon sodium (Na+)
Sự hình thành ion Na+
- Phần tử thu được mang điện tích dương, gọi là ion sodium, kí hiệu Na+.
- Tương tự, nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron, nguyên tử fluorine sẽ đạt được cấu hình electron bền vững sau:
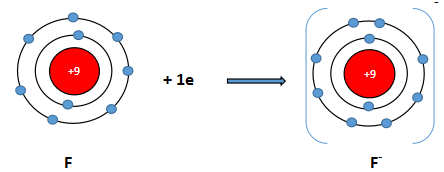
Nguyên tử fluorine (F) Ion fluoride (F-)
Sự hình thành ion F-
- Phân tử thu được mang điện tích âm, gọi là ion fluoride, kí hiệu F-.
- Không phải trong mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc Octet.
- Người ta nhận thấy một số phân tử có thể không tuân theo quy tắc Octet.
Ví dụ: NO, BH3, SF6 ...
- Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một quy tắc khác, tương ứng với quy tắc Octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.
Ví dụ: Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Hướng dẫn giải
- Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine có 7 electron lớp ngoài cùng
+ Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
→ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
→ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung.
Nội dung cùng chủ đề
-
Chương 1. Cấu tạo nguyên tử
-
Chương 2. Bảng tuần hoàn các nguyên tố hóa học
-
Đề thi giữa học kì 1
-
Chương 3. Liên kết hóa học
-
Đề thi cuối học kì 1
-
Chương 4. Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6. Tốc độ phản ứng hóa học
-
Chương 7. Nguyên tố nhóm VIIA - Halogen
-
Đề thi cuối học kì 2







