Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) ![]() 2HCl(g)
2HCl(g)
Biết: EH-H = 436kJ/mol; ECl-Cl = 243 kJ/mol; EH-Cl = 432 kJ/mol.
Biến thiên enthalpy chuẩn của của phản ứng là:
Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) ![]() 2HCl(g)
2HCl(g)
Biết: EH-H = 436kJ/mol; ECl-Cl = 243 kJ/mol; EH-Cl = 432 kJ/mol.
Biến thiên enthalpy chuẩn của của phản ứng là:
Tính biến thiên enthalpy chuẩn của phản ứng:
C3H6(g) + H2(g) → C3H8(g)
Biết Eb (H-H) = 436 kJ/mol, Eb (C-H) = 418 kJ/mol, Eb (C-C) = 346 kJ/mol, Eb (C=C) = 612 kJ/mol.
H2C=CH-CH3 + H-H H3C-CH2-CH2-CH3
= Eb(C=C) + 6Eb(C−H) + Eb(C−C) + Eb(H−H) − 2.Eb(C−C) − 8Eb(C−H)
= 612 + 6.418 + 346 + 436 − 2.346 − 8.418 = − 134 (kJ)
Rót 100 ml dung dịch HCl 0,5M ở 25oC vào 100 ml dung dịch NaHCO3 0,5M ở 26oC. Biết nhiệt dung của dung dịch loãng bằng nhiệt dung của nước là 4,2 J/g.K và nhiệt tạo thành của các chất được cho trong bảng sau:
| Chất | HCl(aq) | NaHCO3(aq) | NaCl(aq) | H2O(l) | CO2(g) |
| -168 | -932 | -407 | -286 | -392 |
Sau phản ứng, dung dịch thu được có nhiệt độ là
Phương trình phản ứng xảy ra:
HCl(aq) + NaHCO3(aq) → NaCl(aq) + H2O(l) + CO2(g)
Biến thiên enthalpy của phản ứng là:
ΔrH = ΔfH(NaCl) + ΔfH(H2O) + ΔfH(CO2) − ΔfH(HCl) − ΔfH(NaHCO3)
= −407 − 286 − 392 + 168 + 932
= 15kJ
Phản ứng thu nhiệt
Ta có: nHCl = nNaHCO3 = 0,1.0,5 = 0,05 mol
Nhiệt lượng thu vào khi cho 0,05 mol HCl tác dụng với 0,05 mol NaHCO3 là:
Q = 0,05.15 = 0,75 kJ
Mà:
Do phản ứng thu nhiệt nên nhiệt độ giảm đi là 0,89oC
Nhiệt độ cuối cùng là 26 – 0,89 = 25,1oC
Cho hai phương trình nhiệt hoá học sau:
![]()
![]()
![]()
![]()
Kết luận nào sau đây là đúng?
Phản ứng (1) và phản ứng (2) có < 0 nên đều là phản ứng tỏa nhiệt.
Cho phương trình nhiệt hoá học của phản ứng:
2H2(g) + O2 (g) → 2H2O (l) ![]() = - 571,68 kJ
= - 571,68 kJ
Phản ứng trên là phản ứng
Phản ứng có = - 571,68 kJ < 0
Phản ứng là phản ứng tỏa nhiệt (có sự giải phóng nhiệt năng ra môi trường).
Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm?
Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì < 0.
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng?
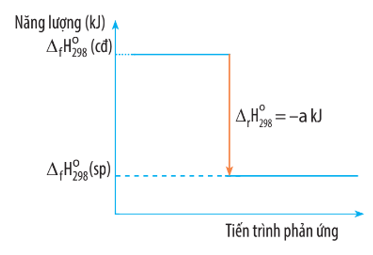
Từ sơ đồ ta thấy: (sp) <
(cđ) nên
< 0 và
= -a kJ
Do đó đây là phản ứng tỏa nhiệt.
Cho phương trình nhiệt hóa học sau:
![]()
Lượng nhiệt giải phóng ra khi chuyển 76,8 gam SO2 (g) thành SO3 (g) là
Theo phương trình nhiệt hóa học, ta có cứ chuyển 1 mol SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là 98,5 kJ.
76,8 gam SO2 (g) có số mol là:
Vậy chuyển 76,8 gam SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là:
98,5.1,2 = 118,2 (kJ)
Cho 0,35 gam bột iron vào bình đựng 20 ml dung dịch CuSO4 0,1M ở 30oC. Khuấy đều dung dịch, quan sát nhiệt kế thấy nhiệt độ lên cao nhất là 37oC. Giả thiết nhiệt lượng của phản ứng tỏa ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước là 4,2J/g.K. Nhiệt của phản ứng là
Nhiệt lượng của dung dịch là Q = m.c.Δt = 20.4,2.(37−30) = 588 J
Phương trình hóa học:
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
Theo đề bài có:
nCuSO4 = 0,02.0,1 = 2.10−3 (mol)
Từ phương trình hóa học Fe là chất dư, CuSO4 là chất hết
Tính nhiệt phản ứng theo chất hết.
Cho phản ứng sau: CH3CH2OH(l) → CH3OCH3(l)
Biết giá trị năng lượng liên kết được cho trong bảng sau:
| Liên kết | C-C | C-H | C-O | O-H |
| Năng lượng liên kết (kJ/mol) | 347 | 413 | 360 | 464 |
Phát biểu nào sau đây không đúng?
Phân tử CH3CH2OH có 1 liên kết C-C, 5 liên kết C-H, 1 liên kết C-O và 1 liên kết O-H:
Eb(CH3CH2OH) = 347 + 5.413 + 360 + 464 = 3236kJ/mol
Phân tử CH3OCH3 có 6 liên kết C-H và 2 liên kết C-O:
Eb(CH3OCH3) = 6.413 + 2.360 = 3198 kJ/mol
= Eb(CH3CH2OH) − Eb(CH3OCH3) = 3236 − 3198 = 38kJ/mol
Tại điều kiện chuẩn CH3CH2OH bền hơn CH3OCH3.
Nhiệt lượng tỏa ra hay thu vào của một phản ứng ở một điều kiện xác định được gọi là
Nhiệt lượng tỏa ra hay thu vào của một phản ứng ở một điều kiện xác định gọi là biên thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là .
Tính biến thiên enthalpy chuẩn của phản ứng
N2(g) + O2(g) → 2NO(g)
Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol; 945 kJ/mol và 607 kJ/mol.
= [945.1 + 494.1] – 607.2 = 225 (kJ)
Để làm nóng khẩu phần ăn, người ta dùng phản ứng giữa CaO với H2O:
CaO(s) + H2O(l) ![]() Ca(OH)2 (aq)
Ca(OH)2 (aq) ![]() = -105kJ
= -105kJ
Giả thiết nhiệt lượng của phản ứng tỏa ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước là 4,2 J/g.K. Cần cho bao nhiêu gam CaO vào 200 gam H2O để nâng nhiệt độ từ 25oC lên 80oC?
Nhiệt lượng tỏa ra là: Q = m.c.Δt = 200.4,2.(80−25) = 46200J = 46,2kJ
Số mol của CaO cần dùng cho phản ứng tỏa ra 46,2kJ là:
Khối lượng CaO cần dùng là 0,44.56 = 24,64 (gam)
Biến thiên enthalpy của phản ứng nào sau đây có giá trị dương?
Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì < 0.
Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng trung bình các liên kết trong các chất cho trong bảng sau:
| Liên kết | Eb (kJ/mol) | Liên kết | Eb (kJ/mol) |
| C=C | 612 | C-C | 346 |
| C-H | 418 | H-H | 436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
= EC=C + 4.EC-H + EH-H – EC-C – 6EC-H
= EC=C + EH-H – EC-C – 2EC-H
= 612 + 436 – 346 – 2.418
= -134 (kJ)
Một phản ứng có ![]() = +131,25 kJ/mol. Đây là phản ứng
= +131,25 kJ/mol. Đây là phản ứng
Phản ứng có = +131,25 kJ/mol > 0
Đây là phản ứng thu nhiệt.
Một mẫu cồn X (thành phần chính là C2H5OH) có lẫn methanol (CH3OH). Đốt cháy 6,2 g cồn X tỏa ra nhiệt lượng 172,8 kJ. Cho phương trình nhiệt hóa học của các phản ứng sau:
![]()
![]()
Thành phần tạp chất methanol trong X là
Gọi số mol của CH3OH và C2H5OH trong X lần lượt là a và b
Theo bài ta có hệ hai phương trình:
mCH3OH = 0,05.32 = 1,6 g
Phần trăm methanol trong X là:
Cho phản ứng sau:
S(s) + O2(g) ![]() SO2(g)
SO2(g) ![]() (SO2, g) = -296,8 kJ/mol
(SO2, g) = -296,8 kJ/mol
Khẳng định sai là
(SO2, g) = -296,8 kJ/mol < 0 nên hợp chất SO2 (g) bền hơn về mặt năng lượng so với các đơn chất bền S (s) và O2 (g).
Biến thiên enthalpy của phản ứng là
Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi.
Phương trình nhiệt hoá học:
3H2 (g) + N2 (g) → 2NH3 (g) ![]() = - 91,80 kJ
= - 91,80 kJ
Lượng nhiệt toả ra khi dùng 9 gam H2 (g) để tạo thành NH3 (g) là
9 gam H2 tương đương với 4,5 mol.
Theo đề bài, phản ứng của 3 mol H2 thể khí với 1 mol N2 thể khí tạo 2 mol NH3 thể khí giải phóng 91,8 kJ nhiệt.
Vậy phản ứng của 9 gam H2 (tương đương với 4,5 mol) ở thể khí tạo thành NH3 ở thể khí giải phóng:
Cho phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn sau:
2NO2 (g) (đỏ nâu) ![]() N2O4 (g) (không màu)
N2O4 (g) (không màu)
Biết NO2 và N2O4 có ![]() tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
= 9,16 - 2.33,18 = -57,2 kJ/mol < 0
Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO.
Biến thiên enthalpy chuẩn của phản ứng được kí hiệu là
Biến thiên enthaly chuẩn của phản ứng được kí hiệu là
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Các phản ứng: nhiệt phân Cu(OH)2, phản ứng giữa H2 và O2 trong hỗn hợp khí, phản ứng đốt cháy cồn đều cần đốt cháy để xảy ra.
Phản ứng giữa Zn và dung dịch H2SO4 có thể tự xảy ra ở điều kiện thường.
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Oxi hóa glucose thành CO2 và H2O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt.
Cho các phản ứng sau:
(a) 2H2S(g) + SO2(g) → 2H2O(g) + 3S(s) ![]() = −237kJ
= −237kJ
(b) 2H2S(g) + O2(g) → 2H2O(g) + 2S(s) ![]() = -530,5 kJ
= -530,5 kJ
Phát biểu nào sau đây đúng?
- Cả hai phản ứng có biến thiên nhiệt mang giá trị âm Phản ứng tỏa nhiệt
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều Phản ứng (a) có trị tuyệt đối của nhiệt phản ứng nhỏ hơn phản ứng (b)
Phản ứng (a) tỏa ra nhiệt lượng ít hơn phản ứng (b).
Ta có:
(a) = 2
(H2O) − 2.
(H2S) −
(SO2) = -237 kJ
(b) = 2
(H2O) − 2.
(H2S) = -530,5 kJ
(SO2) = -530,5 − (-237) = -293,5 kJ
Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 2 : 3. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10.000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
Gọi 2a là số mol của propane trong bình gas ⇒ 3a là số mol của butane trong bình gas.
Theo bài, ta có:
44.2a + 58.3a = 12.1000 ⇒ a = 45,8 mol
Tổng nhiệt lượng tỏa ra khi đốt cháy hoàn toàn một bình gas là:
45,8.2.2220 + 45,8.3.2850 = 594942 kJ
Số ngày mà hộ gia đình sử dụng hết bình gas là:
Cho các phản ứng đốt cháy butane sau:
C4H10(g) + O2(g) → CO2(g) + H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
| Liên kết | C-C | C-H | O=O | C=O | O-H |
| Phân tử | C4H10 | C4H10 | O2 | CO2 | H2O |
| Eb (kJ/mol) | 346 | 418 | 495 | 799 | 467 |
Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước? Giả thiết mỗi ấm nước chứa 3 lít nước ở 25oC, nhiệt dung của nước là 4,2 J/g.K, có 50% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường
Biến thiên enthalpy của phản ứng:
= 3.EC−C + 10.EC−H + 6,5.EO=O −4.2.EC=O −5.2.EO−H
= 3.346 + 10.418 + 6,5.495 − 8.799 − 10.467
= − 2626,5 kJ
Nhiệt lượng cần dùng để đốt cháy 12 kg butane là
Nhiệt cần đun 1 ấm nước là: 3.103.4,2.(100 - 25) = 945000 J = 945 kJ
Số ấm nước cần tìm là:
Đâu là dãy các chất có nhiệt tạo thành chuẩn bằng 0?
Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều bằng 0.
Phát biểu nào sau đây không đúng?
Các phản ứng tỏa nhiệt như CO2 + CaO → CaCO3, phản ứng lên men, ... khó xảy ra hơn khi đun nóng.
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe(s) + 4H2O(l) → Fe3O4(s) + 4H2(g) ![]() = +26,32 kJ
= +26,32 kJ
Giá trị ![]() của phản ứng: Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l) là
của phản ứng: Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l) là
Phản ứng: 3Fe(s) + 4H2O(l) → Fe3O4(s) + 4H2(g) có = +26,32 kJ
Phản ứng Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l) có
= -26,32 kJ
(1) C(s) + H2O(g) ![]() CO(g) + H2(g)
CO(g) + H2(g) ![]() = +131,25 kJ
= +131,25 kJ
(2) CuSO4(aq) + Zn(s) ![]() ZnSO4(aq) + Cu(s)
ZnSO4(aq) + Cu(s) ![]() = -231,04 kJ
= -231,04 kJ
(3) 2C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) ![]() = -1366,89 kJ
= -1366,89 kJ
(4) CH4(g) + H2O(l) ![]() CO(g) + 3H2(g)
CO(g) + 3H2(g) ![]() = +250 kJ
= +250 kJ
(5) CaCO3(s) ![]() CaO(s) + CO2 (g)
CaO(s) + CO2 (g) ![]() = +178,29 kJ
= +178,29 kJ
Số phản ứng tỏa nhiệt và thu nhiệt lần lượt là:
Ta có:
Phản ứng tỏa nhiệt có < 0.
Phản ứng thu nhiệt có > 0.
Phản ứng tỏa nhiệt gồm (2), (3). Phản ứng thu nhiệt gồm (1), (4), (5).
Tính ![]() của phản ứng đốt cháy 21 gam CO (g) biết các sản phẩm thu được đều ở thể khí.
của phản ứng đốt cháy 21 gam CO (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
| Chất | CO (g) | CO2 (g) | O2 (g) |
| −110,5 | −393,5 | 0 |
của phản ứng đốt cháy 1 mol CO (g) là:
=
(CO2(g)) –
(O2(g)) –
(CO(g))
= (-393,5) – ×0 – (-110,5)
= −283 (kJ)
21 gam CO có số mol là:
của phản ứng đốt cháy 21 gam CO (g) là:
(-283) × 0,75 − 283 × 0,75 = − 212,25 (kJ)
Dựa vào phương trình nhiệt hoá học của các phản ứng sau:
CS2(l) + 3O2(g) ![]() CO2(g) + 2SO2(g)
CO2(g) + 2SO2(g) ![]() = - 1110,21 kJ (1)
= - 1110,21 kJ (1)
CO2(g) → CO(g) + O2(g) ![]() = +280,00 kJ (2)
= +280,00 kJ (2)
Na(s) + 2H2O(l) → NaOH(aq) + H2(g) ![]() = - 367,50 kJ (3)
= - 367,50 kJ (3)
ZnSO4(s) → ZnO(s) + SO2(g) ![]() = + 235,21 kJ (4)
= + 235,21 kJ (4)
Cặp phản ứng tỏa nhiệt là:
Phản ứng tỏa nhiệt có < 0.
Phản ứng thu nhiệt có > 0.
Cặp phản ứng tỏa nhiệt là (1) và (3).
Cho các phương trình nhiệt hóa học sau:
(1) CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = −890kJ
= −890kJ
(2) CH3OH(l) + 1,5O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = −726kJ
= −726kJ
(3) CO(g) + 0,5O2(g) → CO2(g) ![]() = −851,5kJ
= −851,5kJ
(4) SO2(g) + 0,5O2(g) → SO3(l) ![]() = −144,2kJ
= −144,2kJ
Thứ tự sắp xếp theo chiều tăng dần về lượng nhiệt tỏa ra khi đốt cháy 1 mol mỗi chất?
Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều
Thứ tự: (4), (2), (3), (1).
Chọn câu trả lời đúng
Enthalpy tạo thành chuẩn của một đơn chất bền?
Enthalpy tạo thành chuẩn của một đơn chất bền bằng 0.
Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
| Chất | Al | Fe2O3 | Al2O3 | Fe |
| 0 | -5,14 | -16,37 | 0 | |
| C(J/g.K) | 0,84 | 0,67 |
Giả thiết phản ứng xảy ra vừa đủ, hiệu suất 100%; nhiệt độ ban đầu là 25oC; nhiệt lượng tỏa ra bị thất thoát ra ngoài môi trường là 40%. Nhiệt độ đạt được trong lò phản ứng nhiệt nhôm là
Biến thiên enthalpy của phản ứng:
=
(Al2O3) + 2.
(Fe) + 2.
(Al) -
(Fe2O3)
= 102.(−16,37) + 2.0 − 2.0 −160.(−5,14)
= −847,34 kJ
Nhiệt dung của sản phẩm là: C = 102.0,84 + 2.56.0,67 = 160,72 (J.K-1)
Nhiệt độ tăng lên là
Nhiệt độ đạt được là: (25 + 273) + 3163 = 3461 K
Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(g)
CO2(g) + 2H2O(g)
Biết nhiệt tạo thành ![]() của CH4(g) là -74,9 kJ/mol, của CO2 (g) là -393,5 kJ/mol, của H2O (l) là -285,8 kJ/mol.
của CH4(g) là -74,9 kJ/mol, của CO2 (g) là -393,5 kJ/mol, của H2O (l) là -285,8 kJ/mol.
Tổng nhiệt tạo thành các chất đầu là:
(cđ) =
(CH4(g)) +
(O2(g)).2 = –74,9 + 0.2 = –74,9 (kJ)
Tổng nhiệt tạo thành sản phẩm là:
(sp) =
(CO2(g)) +
((H2O)).2 = –393,5 + (–285,8).2 = –965,1 (kJ)
Biến thiên enthalpy của phản ứng là:
=
(sp) –
(cđ) = –965 – (–74,9) = –890,2 (kJ)
Cho phương trình hóa học của phản ứng:
C2H4(g) + H2O(l) → C2H5OH(l)
Biến thiên enthalpy của phản ứng là
Biết:
| Chất | C2H5OH | C2H4 | H2O |
| -277,63 | +52,47 | -285,84 |
Biến thiên enfhalpy của phản ứng tính theo nhiệt tạo thành chuẩn:
=
(C2H5OH) -
(C2H4) -
(H2O)
= - 277,63 - (+52,47) - (-285,84) = -44,26 kJ.
Điều chế NH3 từ N2 (g) và H2 (g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Biết khi sử dụng 14 g khí N2 sinh ra 45,9 kJ nhiệt. Phương trình nhiệt hóa học của phản ứng tạo thành NH3 là
Phương trình hóa học: N2(g) + 3H2(g) → 2NH3(g)
Theo đề bài khi sử dụng 14 g khí N2 tức 0,5 mol khí N2 sinh ra 45,9 kJ nhiệt
Khi sử dụng 1 mol khí N2 sinh ra 91,8 kJ nhiệt
Phương trình nhiệt hóa học của phản ứng tạo thành NH3 là
N2(g) + 3H2(g) → 2NH3(g) = −91,8kJ
Cho phương trình nhiệt hóa học của phản ứng:
C(s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = -393,5 kJ
= -393,5 kJ
Ý nghĩa của ![]() = -393,5 kJ là gì?
= -393,5 kJ là gì?
Ý nghĩa của = -393,5 kJ là: Để đốt cháy hoàn toàn 1 mol carbon trong khí oxygen dư (ở 35oC, 1atm) tạo ra 1 mol CO2 tỏa ra một lượng nhiệt là 393,5 kJ.
