Các electron hóa trị là
Các electron hóa trị là các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Các electron hóa trị là
Các electron hóa trị là các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Năng lượng liên kết của phân tử H2 là 436 kJ/mol cho biết điều gì?
Năng lượng liên kết của phân tử H2 là 436 kJ/mol cho biết: Để phá vỡ 1 mol liên kết H-H thành các nguyên tử H (ở thể khí) cần năng lượng là 432 kJ.
Một hợp chất có công thức XY2 trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron lớp ngoài cùng của X, Y và liên kết trong phân tử XY2 lần lượt là
Y chiếm 50% về khối lượng nên ta có:
MX = 2MY nX + pX = 2nY + 2pY (1)
Theo bài ra ta có: nX = pX; nY = pY; thay vào (1) ta được:
2pX = 4pY pX = 2pY (2)
Mà: pX + 2pY = 32 (3)
Từ (1) và (2) ta có pX = 16; pY = 8
pX = 16 (S): [Ne]3s23p4; pY = 8 (O): [He]2s22p4
Phân tử XY2 là SO2
Liên kết trong phân tử SO2 là liên kết cộng hóa trị.
Liên kết ion trong phân tử hay tinh thể được tạo thành
Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Các hợp chất tạo nên từ các ion được gọi là những hợp chất ion.
Phát biểu nào sau đây không đúng?
Liên kết ion thường được tạo thành từ các nguyên tử kim loại điển hình và phim kim điển hình.
Nguyên tử nguyên tố T có tổng số hạt cơ bản là 24 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8 hạt. Trong ion G4+ tổng số hạt cơ bản là 14 hạt, số hạt mang điện nhiều hơn số hạt không mang điện là 2 hạt. Liên kết hoá học trong phân tử giữa T và G là:
Trong nguyên tử X:
- Tổng số hạt: 2ZX + NX = 24
- Số hạt mang điện nhiểu hơn số hạt không mang điện: 2ZX – NX = 8
ZX = 8 (O)
Trong ion G4+:
- Tổng số hạt: (2ZY – 4) + NY = 14
- Số hạt không mang điện nhiều hơn số hạt mang điện: (2ZY – 4) - NY = 2
ZY = 6 (C)
Liên kết giữa C và O là liên kết cộng hóa trị có cực.
Cho các phát biểu sau:
(a) Liên kết đôi được tạo nên từ hai liên kết σ.
(b) Liên kết ba được tạo nên từ 2 liên kết σ và 1 liên kết π.
(c) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(d) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Số phát biểu đúng là:
(a) Sai, liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(b) Sai, liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
(c) Đúng.
(d) Đúng.
Cho các phát biểu sau:
(a) Liên kết trong phân tử HCl, H2O là liên kết cộng hóa trị có cực.
(b) Trong phân tử CH4, nguyên tố C có cộng hóa trị là 4.
(c) Dãy sắp xếp thứ tự tăng dần độ phân cực liên kết trong phân tử: H2O, H2S, Na2O, K2O (biết ZO = 8; ZS = 16).
(d) Trong phân tử C2H2 có một liên kết ba.
Phát biểu không đúng là
(c) Sai vì:
+ Độ âm điện O > S
O –
H >
S –
H
H-O phân cực hơn H-S
+ Độ âm điện Na > K
O –
Na <
O –
K
Na-O kém phân cực hơn K-O
Hợp chất nào dưới đây có cả liên kết cộng hóa trị và liên kết ion trong phân tử?
Liên kết giữa 2 nguyên tử cùng loại là liên kết cộng hóa trị không cực.
H2S chỉ có liên kết cộng hóa trị.
Al2O3 và NaCl chỉ có liên kết ion.
NaOH gồm liên kết ion giữa Na+ và OH−, liên kết cộng hóa trị giữa O và H.
Cho các ion sau: S2-, Cl-, K+, Ca2+ đều có cấu hình là [Ne]3s23p6. Dãy sắp xếp nào sau đây về bán kính các ion là đúng:
Do các ion trên đều có cầu hình giống nhau ⇒ Số lớp electron giống nhau ⇒ Bán kính nguyên tử phụ thuộc vào lực hút giữa electron với hạt nhân nguyên tử
Với ion dương: giá trị điện tích ion càng lớn thì lực hút càng mạnh ⇒ Bán kính giảm
Với ion âm: giá trị điện tích ion càng lớn thì lực hút càng yếu ⇒ Bán kính tăng
Các ion K+, S2-, Cl-, Ca2+ đều có 18 electron
⇒ Chiều sắp xếp giảm dần bán kính các ion là S2− > Cl− > K+ > Ca2+-.
Cấu hình electron ở lớp ngoài cùng của các nguyên tố ns2np5. Liên kết của các nguyên tố này với nguyên tố hydrogen thuộc loại liên kết nào sau đây?
Cấu hình e lớp ngoài cùng là ns2np5 có xu hướng nhận thêm 1e
Trong hợp chất khí với H, X có hóa trị I → Công thức hóa học của hợp chất khí với H: HX
Liên kết cộng hóa trị phân cực.
Phát biểu nào sau đây sai?
Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện. Tuy nhiên, ở trạng thái nóng chảy, các ion có thể chuyển động khá tự do nên hợp chất ion dẫn điện.
Cho biết tổng số electron trong anion AB32- là 42. Trong các hạt nhân A cũng như B có số proton bằng với số neutron. Khi đốt hỗn hợp A, B thu được một hợp chất C. Cho biết C thuộc loại liên kết gì?
Tổng số electron trong anion AB32- là 42 eA + 3.eB + 2 = 42
pA + 3.pB = 40
Trong hạt nhân A cũng như B có số proton bằng số neutron nA = pA ; nB = pB
pA = 16 (S) và pB = 8 (O) vì hạt nhân S và O có số p = số n
hợp chất C là SO2
Hiệu độ âm điện = 3,44 – 2,58 = 0,86
Liên kết trong C là liên kết cộng hóa trị có cực.
Z là một nguyên tố mà nguyên tử có chứa 12 proton, còn Y là một nguyên tố mà nguyên tử có chứa 9 proton. Công thức của hợp chất hình thành giữa các nguyên tố này là
Cấu hình electron của Z là: 1s22s22p63s2 Z là kim loại (Mg). Z có xu hướng nhường 2 electron để được cấu hình bền.
Cấu hình electron của Y là: 1s22s22p5 Y là phi kim (Cl). Y có xu hướng nhận 1 electron để được cấu hình bền
Liên kết với Y và Z là liên kết ion (tạo thành từ kim loại điển hình và phi kim điển hình), tạo phân tử ZY2.
Nguyên tố aluminium thuộc nhóm IIIA. Số electron hóa trị của nguyên tử nguyên tố aluminium là
Số electron hóa trị = Số thứ tự nhóm A = 3.
Nguyên tử aluminium có 3 electron hóa trị.
Cho các nhận định sau:
(1) Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) Các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước.
(3) Hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là điện hóa trị của nguyên tố đó.
(4) Liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) Khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Số nhận định đúng là
(1) đúng vì liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) đúng vì các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước (dung môi phân cực).
(3) sai vì hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là cộng hóa trị của nguyên tố đó.
(4) đúng vì hiệu độ âm điện của 2 nguyên tử giống nhau bằng 0 nên liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) đúng vì khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Vậy có 4 phát biểu đúng.
Khi tạo liên kết hóa học thì nguyên tử có xu hướng
Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
Theo bài ra ta có:
X là sulfur, Y là chlorine
Nhận xét:
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
Muối X được tạo thành bởi một kim loại hóa trị II và phi kim hóa trị I. Hòa tan 4,44 gam X vào H2O rồi chia làm hai phần bằng nhau
- Cho phần một tác dụng với dung dịch AgNO3 dư thu được 5,74 gam kết tủa.
- Cho phần hai tác dụng với dung dịch Na2CO3 dư thu được 2 gam kết tủa.
Liên kết trong X là liên kết
Đặt kim loại A, phi kim B ⇒ Muối X là AB2
Khối lượng AB2 trong mỗi phần là 4,44 : 2 = 2,22 g
AB2 + 2AgNO3 → 2AgB + A(NO3)2
AB2 + Na2CO3 → ACO3 + 2NaB
Từ (1) và (2) ⇒ A = 40 (Ca); B = 35,5 (Cl)
Ca là một kim loại điển hình, Cl là một phi kim điển hình nên liên kết của X là liên kết ion.
Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng
Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau.
Dãy phân tử nào cho dưới đây đều có liên kết cộng hóa trị không phân cực?
Liên kết cộng hóa trị không phân cực là liên kết mà trong đó đôi electron dùng chung không bị lệch về phía nguyên tử nào cả.
⇒ Liên kết cộng hóa trị không cực thường được hình hình thành giữa các nguyê tử của cùng một nguyên tố.
⇒ Dãy phân tử đều có liên kết cộng hóa trị không phân cực là: Cl2, O2, N2, F2.
Trong phân tử NH3, số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là?
Nguyên tử N có 5 electron ở lớp ngoài cùng, nguyên tử N có xu hướng góp chung 3 electron với 3 nguyên tử H. Số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là 3.
Phát biểu nào sau đây không đúng?
Cấu trúc của tinh thể ion:
Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau), tạo thành mạng tinh thể ion.
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là
Liên kết cộng hóa trị có: 0,4 < < 1,7.
Các chất trong phân tử chỉ chứa liên kết cộng hóa trị phân cực là: H2O, HF, H2S.
Chất nào sau đây có thể tạo liên kết hydrogen với chính nó?
Điều kiện cần và đủ để tạo thành liên kết hydrogen:
CO2, F2, H2 không có liên kết hydrogen.
Nguyên tử chlorine có Z = 17. Số electron hóa trị của nguyên tử chlorine là
Cấu hình electron của nguyên tử chlorine (Z = 17): 1s22s22p63s23p5.
Electron cuối cùng điền vào phần lớp p Chlorine thuộc nhóm A.
Số electron hóa trị = Số electron lớp ngoài cùng = 7.
Cho ba chất C2H5OH, HCOOH, CH3COOH và các giá trị nhiệt độ sôi là 118,2oC; 78,3oC; 100,5oC. Hãy sắp xếp nhiệt độ sôi phù hợp vào đúng mỗi chất?
Chất nào tạo được nhiều liên kết hydrogen trong phân tử thì có nhiệt độ sôi cao
Một phân tử C2H5OH tạo được 2 liên kết hydrogen với các phân tử C2H5OH xung quanh
Một phân tử HCOOH tạo được 3 liên kết hydrogen với các phân tử HCOOH xung quanh
Một phân tử CH3COOH tạo được 3 liên kết hydrogen với các phân tử CH3COOH xung quanh
⇒ Độ sôi của C2H5OH nhỏ hơn của HCOOH và CH3COOH.
Có diện tích tiếp xúc giữa các phân tử trong CH3COOH lớn hơn trong HCOOH hay khối lượng mol của CH3COOH lớn hơn khối lượng mol của HCOOH.
⇒ Độ sôi của HCOOH nhỏ hơn của CH3COOH.
⇒ Thứ tự tăng dần về nhiệt độ sôi: C2H5OH, HCOOH, CH3COOH.
Gán giá trị nhiệt độ: C2H5OH: 78,3oC; HCOOH: 100,5oC; CH3COOH: 118,2oC.
Cho các nguyên tử X, Y:
- Tổng số các loại hạt cơ bản trong nguyên tử X là 34. Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
- Kí hiệu của nguyên tử Y là ![]() .
.
Công thức hóa học và liên kết trong hợp chất tạo thành từ X và Y là
Xác định X:
Theo bài ra ta có hệ phương trình:
Cấu hình electron của X là: [Ne]3s1 X là kim loại nhóm IA.
X có xu hướng nhường 1e khi hình thành liên kết hóa học:
X → X+ + 1e
- Cấu hình electron của Y là: [He]2s22p5 Y là phi kim nhóm VIIA hoặc từ kí hiệu nguyên tử xác định Y là fluorine.
Y có xu hướng nhận 1e khi hình thành liên kết hóa học:
Y + 1e → Y-
Vậy hợp chất tạo thành là XY; liên kết trong hợp chất là liên kết ion.
Cho các chất: HBr, HI, HCl, HF. Căn cứ vào hiệu độ âm điện của các nguyên tố, mức độ phân cực của liên kết hóa học trong phân tử các chất này được sắp xếp theo thứ tự giảm dần từ trái sang phải là
Độ âm điện của H là 2,2
Từ Cl đến I độ âm điện giảm dần
Vậy sắp xếp các chất theo thứ tự giảm dần độ phân cực của liên kết là: HF, HCl, HBr, HI.
Cho độ âm điện của các nguyên tố: O = 3,44; Cl = 3,16; N = 3,04; C = 2,55; H = 2,20. Trong các hợp chất: H2O, NH3, HCl, CH4. Số hợp chất chứa liên kết cộng hóa trị có cực là:
Trong các nguyên tử của các nguyên tố sau: Ca, Cl, Fe, O, Mg. Có bao nhiêu nguyên tử có xu hướng nhận thêm electron để đạt tới cấu hình bền vững?
Các nguyên tử của các nguyên tố phi kim có xu hướng nhận thêm electron để đạt tới cấu hình bền vững: Cl, O.
Cấu hình electron của Ca: 1s22s22p63s23p64s2
Ca có xu hướng nhường 2 electron để đạt tới cấu hình bền vững.
Cấu hình electron của Cl: 1s22s22p63s23p5
Cl có xu hướng nhận 1 electron để đạt tới cấu hình bền vững.
Cấu hình electron của Fe: 1s22s22p63s23p63d64s2
Fe có xu hướng nhường 2 hoặc 3 electron để đạt tới cấu hình bền vững.
Cấu hình electron của O: 1s22s22p4
O có xu hướng nhận 2 electron để đạt tới cấu hình bền vững.
Cấu hình electron của Mg: 1s22s22p63s2
Mg có xu hướng nhường 2 electron để đạt tới cấu hình bền vững.
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
Phân tử CS2 được biểu diễn:
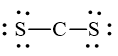
Tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là 4.
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào
Mức độ liên kết hydrogen của hợp chất phụ thuộc vào trạng thái vật chất của hợp chất.
Mô tả sự hình thành ion của nguyên tử Mg (Z = 12) theo quy tắc octet là
Mg (Z = 12) có cấu hình electron: 1s22s22p63s2 ⇒ Có 2 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, Mg có xu hướng nhường 2 electron lớp ngoài cùng để trở thành ion mang điện tích dương.
Mg ⟶ Mg2+ + 2e
Nhóm chất nào sau đây có liên kết “cho - nhận?
Nhóm có liên kết cho nhận là: NH4NO3 và HNO3
Trong phân tử hợp chất Y gồm 2 nguyên tử của nguyên tố X liên kết với 1 nguyên tử oxygen và có phân tử khối là 62 amu. Hãy xác định số nhận định đúng dưới đây?
(a) Nguyên tố X là Na.
(b) Số oxi hóa của X trong Y là +1.
(c) Nguyên tử X có 2 electron ở lớp ngoài cùng.
(d) Liên kết hóa học trong phân tử Y là liên kết ion.
(e) Hòa tan Y vào nước được dung dịch base.
Gọi công thức hóa học của Y là X2O, ta có:
MY = 2MX + MO = 62 amu
MX = 23
Vậy X là nguyên tố sodium (Na)
Xét các nhận định:
(a) đúng.
(b) đúng.
(c) sai vì cấu hình electron của X là 1s22s22p63s1 nên X chỉ có 1 electron ở phân lớp ngoài cùng.
(d) đúng.
(e) đúng.
Nguyên tử Mg có Z = 12. Cấu hình electron của ion Mg2+ là
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2.
Nguyên tử Mg nhường 2 electron để tạo thành ion Mg2+: Mg Mg2+ + 2e.
Cấu hình electron của ion Mg2+ là 1s22s22p6 (giống khí hiếm Neon).
Cho dãy các ion: Na+, Al3+, SO42-, NH4+, NO3-, Cl-, Ca2+. Số cation trong dãy trên là
Cation là các ion mang điện tích dương, anion là các ion mang điện tích âm.
Các cation trong dãy là: Na+, Al3+, NH4+, Ca2+.
Dãy các phân tử đều có liên kết ion là
- Cl2, Br2, I2, HCl: Cả 4 chất đều là liên kết cộng hóa trị.
- HCl, H2S, NaCl, Na2O: Dãy có HCl, H2S, Na2O là liên kết cộng hóa trị.
- Na2O, KCl, BaCl2, Al2O3: Cả 4 chất đều là liên kết ion.
- MgO, H2SO4, H3PO4, HCl: Trong dãy có H2SO4, H3PO4, HCl là liên kết cộng hóa trị.
