Ôn tập chương 2
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
Điện tích hạt nhân tăng dần.
Cùng số lớp electron → cùng chu kì (hàng).
Cùng số electron hóa trị → cùng nhóm (cột).
b) Trong bảng tuần hoàn (đến năm 2016) có 118 nguyên tố, 7 chu kì và 18 nhóm.
2. Xu hướng biến đổi trong bảng tuần hoàn
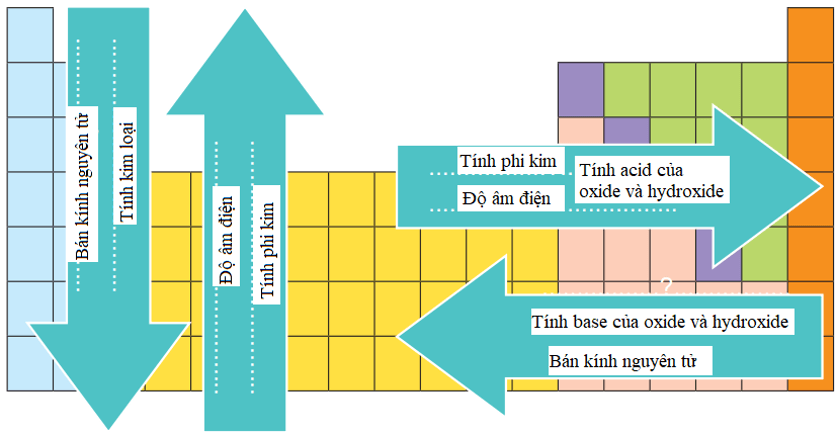
Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
3. Bảng tuần hoàn và cấu tạo nguyên tử
Nhận xét:
Số proton = số electron = số hiệu nguyên tử = số Z
Số thứ tự chu kì = số lớp electron
Số thứ tự nhóm A = số electron lớp ngoài cùng
4. Định luật tuần hoàn
5. Ví dụ luyện tập
Ví dụ 1. Cho các nguyên tố X (Z = 11), Y (Z = 13), T (Z = 14), Q (Z = 19).
a) So sánh tính kim loại
b) So sánh bán kính nguyên tử
Hướng dẫn giải
X (Z = 11): 1s22s22p63s1 → X thuộc chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 → Y thuộc chu kì 3, nhóm IIIA.
T (Z = 14): 1s22s22p63s23p2 → T thuộc chu kì 3, nhóm IVA.
Q (Z = 19): 1s22s22p63s23p64s1 → Q thuộc chu kì 4, nhóm IA.
a) So sánh tính kim loại.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
→ Tính kim loại: X > Y > T.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
→ Tính kim loại: X < Q.
Vậy, tính kim loại: Q > X > Y > T.
b) So sánh bán kính nguyên tử
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X > Y > T.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X < Q.
Vậy, bán kính nguyên tử: Q > X > Y > T.
Ví dụ 2. Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn.
a) Viết cấu hình electron của nguyên tử S.
b) Xác định số proton, electron của nguyên tử S.
c) Viết công thức oxide cao nhất và hydroxide cao nhất của S.
Hướng dẫn giải
a)
Số thứ tự chu kì = số lớp electron = 3.
Số thứ tự nhóm A = số electron lớp ngoài cùng = 6.
→ Cấu hình electron của nguyên tử S: 1s22s22p63s23p4.
b) Số proton = số electron = Z = 16.
c) S thuộc nhóm VIA → Hóa trị cao nhất của S là VI.
Công thức oxide cao nhất của S là SO3
Công thức hydroxide cao nhất là H2SO4 (có tính acid).
-
Chương 1: Cấu tạo nguyên tử
-
Chương 2: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn
-
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
-
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
-
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
-
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
-
Bài 9: Ôn tập chương 2
-
-
Đề thi giữa học kì 1
-
Chương 3: Liên kết hóa học
-
Đề thi ôn tập học kì 1
-
Chương 4: Phản ứng oxi hóa - khử
-
Chương 5. Năng lượng hóa học
-
Đề thi giữa học kì 2
-
Chương 6: Tốc độ phản ứng
-
Chương 7: Nguyên tố nhóm Halogen
-
Để ôn tập Học kì 2







