Nhóm chất nào sau đây có liên kết "cho - nhận"?
Nhóm chất có liên kết "cho - nhận" là:
![]()
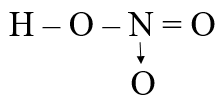
Nhóm chất nào sau đây có liên kết "cho - nhận"?
Nhóm chất có liên kết "cho - nhận" là:
![]()
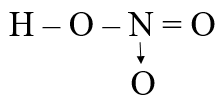
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là:
Liên kết N≡N trong N2 là liên kết cộng hóa trị không phân cực
Liên kết O=O → O trong O3 là liên kết cộng hóa trị không phân cực và có liên kết cho – nhận
Liên kết Cl-Cl trong Cl2 là liên kết cộng hóa trị không phân cực.
Vậy dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là H2O, HF, NH3
Nhóm chất nào sau đây đều là hợp chất ion?
Liên kết ion thường tạo thành giữa một nguyên tử kim loại mạnh (dễ nhường electron tạo ion dương) và một nguyên tử phi kim mạnh (dễ nhận electron để tạo ion âm).
→ Các chất trong dãy đều có liên kết ion là: CaO, KCl.
Nguyên tố Y có cấu hình electron lớp ngoài cùng 4s1 thuộc chu kì:
Nguyên tố Y có cấu hình electron lớp ngoài cùng 4s1 thuộc chu kì 4
Số electron trong ion PO43- là (biết P(Z=15); O(Z=8))
Số electron trong ion PO43- là
15 + 4.8 + 3 = 50
Nguyên tử X có cấu hình [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là:
Cấu hình electron đầy đủ của X: 1s22s22p63s23p1
→ Z = 13 = số thứ tự, chu kì 3 (có 3 lớp electron), nhóm IIIA, (có 3 lớp ngoài cùng, là nguyên tố p).
Quá trình tạo thành ion Ca2+ nào sau đây đúng?
Calcium có 2 electron lớp ngoài cùng, có xu hướng nhường đi 2 electron khi hình thành liên kết hóa học.
Ca → Ca2+ + 2e
Tổng số hạt proton trong hai ion XA32- và XA42- lần lượt là 40 và 48. Nguyên tố X là:
Tổng số hạt proton trong hai ion XA32- và XA42-
⇒ SO32- và SO42-
Vậy nguyên tố X là S
Dãy các nguyên tố nào sau đây sắp xếp theo chiều tăng dần bán kính nguyên tử?
F, O, C, Be thuộc cùng chu kì 2, theo quy luật biến đổi có bán kính nguyên tử:
F < O < C < Be (1)
Be và Ca thuộc cùng nhóm IIA, theo quy luật biến đổi có bán kính nguyên tử:
Be < Ca (2)
Từ (1) và (2) có bán kính nguyên tử: F < O < C < Be < Ca.
Oxide cao nhất của một nguyên tố R có công thức RO3. Hợp chất của R với hydrogen chứa 5,88% hydrogen về khối lượng.
Cho các phát biểu sau:
(1) R có độ âm điện lớn và một kim loại.
(2) R là nguyên tố Si.
(3) R thuộc nhóm IIIA của bảng tuần hoàn.
(4) Hydroxide của R có công thức H2RO4 và là acid mạnh.
(5) R có thể tạo thành ion bền có dạng R+.
Số phát biểu đúng là:
Oxide cao nhất của nguyên tố R là RO3.
Công thức hợp chất khí với hydrogen của R là RH2.
Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng nên:
%R = 100% - 5,88% = 94,12%
⇒ MR = 32 (R chính là S)
R chính là nguyên tố sulfur (S) là phi kim
S thuộc nhóm VIA trong bảng tuần hoàn.
Hydroxide của S có công thức H2SO4 và là acid mạnh.
S có xu hướng nhận thêm 2 electron để đạt cấu hình bền của khí hiếm gần nó nhất là Ar ⇒ S có tính phi kim.
S + 2e ⟶ S2-
Chất vừa có liên kết cộng hóa trị phân cực, vừa có liên kết cộng hóa trị không phân cực là:
Phân tử C2F6 vừa có liên kết cộng hóa trị phân cực (liên kết giữa C và F), vừa có liên kết công hóa trị không phân cực (liên kết giữa C với C).
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Trong phân tử BH3 nguyên tử B mới chỉ có 6 electron ở lớp ngoài cùng, chưa đạt được cấu hình electron bền vững của khí hiếm gần nhất.
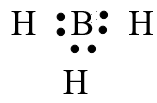
Trong bảng tuần hoàn các nguyên tố hóa học, nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cùng
Trong bảng tuần hoàn các nguyên tố hóa học, nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cùng số electron hóa trị.
Nguyên tố X (Z = 18) thuộc chu kì
Ta có cấu hình electron nguyên tử X:1s22s22p63s23p6.
Nguyên tố này thuộc chu kì 3 vì có 3 lớp electron.
Hòa tan hết 12,34 gam hỗn hợp X gồm 3 kim loại thuộc nhóm IA và IIA tác dụng với lượng dư dung dịch H2SO4 loãng thu được 4,958 lít khí H2 (đkc) và dung dịch chứa m gam hỗn hợp muối sulfate trung hòa. Giá trị của m là:
nH2 = 4,958 : 24,79 = 0,2 mol
Gọi R là kim loại chung cho hỗn hợp X với hóa trị n
Sơ đồ phản ứng
M + H2SO4 → M2(SO4)n + H2
Áp dụng bảo toàn nguyên tố H ta có:
nH2SO4 phản ứng = nH2 = 0,2 mol
Áp dụng bảo toàn khối lượng ta có:
mM + mH2SO4 phản ứng = mH2 + mM2(SO4)n
⇒ mM2(SO4)n = mM + mH2SO4 phản ứng - mH2 = 12,34 + 98.0,2 - 0,2.0,2 = 31,54 gam
Công thức nào sau đây là công thức Lewis
Công thức biểu diễn theo công thức Lewis là

Phần được tạo thành khi nguyên tử mất đi electron là:
Phần được tạo thành khi nguyên tử mất đi electron là cation
Nguyên tử nào sau đây có tính kim loại mạnh nhất?
Dựa vào quy luật biến đổi tính kim loại, có kim loại mạnh nhất nằm ở đầu chu kì, hay nằm ở nhóm IA.
Lại có trong 1 nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, nên kim loại mạnh nhất là Caesium.
Cho các phát biểu sau về bảng tuần hoàn các nguyên tố hoá học?
(1) Số thứ tự của nhóm luôn luôn bằng số electron ở lớp vỏ ngoài cùng của nguyên tử nguyên tố thuộc nhóm đó.
(2) Số electron ở lớp vỏ ngoài cùng càng lớn thì số thứ tự của nhóm càng lớn.
(3) Nguyên tử các nguyên tố trong cùng một hàng có cùng số lớp electron.
(4) Nguyên tử các nguyên tố trong cùng một cột có cùng số electron hoá trị.
Phát biểu đúng là:
Phát biểu (1) sai vì chỉ các nguyên tố nhóm A thì số thứ tự của nhóm luôn luôn bằng số electron ở lớp vỏ ngoài cùng của nguyên tử nguyên tố thuộc nhóm đó.
Phát biểu (2) sai.
Ví dụ:
Fe thuộc nhóm VIIIB nhưng chỉ có 2 electron ở lớp ngoài cùng.
Phát biểu (3) và (4) đúng.
Oxide nào dưới đây là oxide lưỡng tính?
Oxide lưỡng tính Al2O3
Cho các cấu hình electron sau:
(1) 1s22s1
(2) 1s22s22p4.
(3) 1s22s22p63s23p63d104s24p5.
(4) 1s22s22p63s23p1.
Số cấu hình electron của nguyên tố phi kim là
Các nguyên tố mà nguyên tử có 1,2,3 electron ở lớp ngoài cùng là nguyên tố kim loại (trừ H, He, B)
Các nguyên tố mà nguyên tử có 5,6,7 electron ở lớp ngoài cùng là nguyên tố phi kim.
Các nguyên tố mà nguyên tử có 4 electron, thì có thể là nguyên tố kim loại hoặc phi kim.
Xét các cấu hình sau
(1) 1s22s1
Có 1 electron lớp ngoài cùng ⇒ Nguyên tố kim loại
(2) 1s22s22p4.
Có 6 electron lớp ngoài cùng ⇒ Nguyên tố phi kim
(3) 1s22s22p63s23p63d104s24p5.
Có 7 electron lớp ngoài cùng ⇒ Nguyên tố phi kim
(4) 1s22s22p63s23p1.
Có 3 electron lớp ngoài cùng ⇒ Nguyên tố kim loại
Cặp nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
Nguyên tử là đồng vị của nhau vì cùng có 5 proton trong hạt nhân nhưng khác nhau về số neutron (X có 6 neutron còn Y có 7 neutron).
Phát biểu nào sau đây không đúng?
Phát biểu "Nguyên tử có cấu trúc đặc khít" không đúng vì nguyên tử có cấu tạo rỗng.
Tổng số hạt trong nguyên tử nguyên tố R là 82. Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4. Kí hiệu nguyên tử R là:
Gọi số hạt proton, neutron, electron trong một nguyên tử R lần lượt là p, n, e.
Ta có: p = e
Tổng số hạt trong nguyên tử X là: p + n + e= 2p + n = 82 (1)
Số hạt mang điện trong hạt nhân nguyên tử là: p
Số hạt không mang điện trong hạt nhân nguyên tử là: n
Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4
⇒ n – p = 4 (2)
Từ (1) và (2) ta có hệ phương trình:
Vì số hiệu nguyên tử Z = số p ⇒ Z = 26
⇒ R có kí hiệu hóa học là Fe.
Số khối: A = p + n = 26 + 30 = 56
Kí hiệu nguyên tử của R là
Một loại nguyên tử potassium có 19 proton, 19 electron và 20 neutron. Số khối của nguyên tử này là
Số khối A = số proton + số neutron = 19 + 20 = 39
Vậy số khối của nguyên tử này là 39
Chọn từ thích hợp điền vào chỗ trống trong mỗi phát biểu sau:
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân.
b) Kích thước hạt nhân rất nhỏ so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
Chọn từ thích hợp điền vào chỗ trống trong mỗi phát biểu sau:
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân.
b) Kích thước hạt nhân rất nhỏ so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân.
b) Kích thước hạt nhân rất nhỏ so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
Cho hai nguyên tố X (Z = 19) và Y (Z = 17). Công thức hợp chất tạo thành từ nguyên tố X, Y và liên kết trong phân tử là
X (Z = 19): 1s22s22p63s23p64s1
Y (Z = 17): 1s22s22p63s23p5
Nguyên tử X là kim loại mạnh, có xu hướng nhường đi 1 electron lớp ngoài cùng tạo thành cation X+.
Nguyên tử Y là phi kim điển hình, có xu hướng nhận thêm 1 electron và lớp ngoài cùng tạo thành anion Y-.
Ion X+ và Y- trái dấu hút nhau tạo thành phân tử XY. Liên kết được tạo thành là liên kết ion.
X+ + Y- → XY
Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2. Số phân tử có liên kết cộng hóa trị không phân cực là:
Phân tử có liên kết cộng hóa trị không phân cực: Br2.
Phân tử có liên kết cộng hóa trị phân cực: H2S, CH4, NH3, C2H4 và C2H2.
Hợp chất khí với hydrogen của Y là YH4. Oxide cao nhất của nó chứa 46,67% Y về khối lượng. Nguyên tố Y là:
Hợp chất khí với hydrogen của nguyên tố X có công thức YH4.
Oxide cao nhất của Y là YO2 . Gọi Y là nguyên tử khối của Y, theo bài ra ta có:
Hợp chất khí với hydrogen của Y là YH4 ⇒ Y có hóa trị IV Oxide cao nhất là YO2
⇒ MY = 28. Vậy Y là Si.
Trong các phân tử sau, phân tử nào có liên kết ba giữa hai nguyên tử là:
Ta có công thức cấu tạo của các chất:
F – F; O = C = O; H – H; N ≡ N.
Vậy chỉ có phân tử chỉ có liên kết ba giữa hai nguyên tử là N2.
Cho nguyên tố X, Y là hai nguyên tố cùng một nhóm A ở hai chu kì nhỏ liên tiếp nhau trong bảng tuần hoàn và ZX + ZY = 32 (ZX < ZY). Xác định nguyên tố X.
Gọi ZX, ZY lần lượt là số proton của nguyên tử nguyên tố X và Y. Ta có:
ZX + ZY = 32 (1)
Vì X và Y thuộc cùng nhóm A ở hai chu kì kế tiếp nhau nên số proton của chúng khác nhau 8, 18 hoặc 32 đơn vị.
Giả sử ZY > ZX.
Trường hợp 1: ZY – ZX = 8 (2)
Kết hợp (1) và (2) giải hệ phương trình ta được: ZX = 12; ZY = 20.
Cấu hình electron của X: 1s22s22p63s2 (nhóm IIA).
Cấu hình electron của Y: 1s22s22p63s23p64s2 (nhóm IIA).
Vậy trường hợp 1 thỏa mãn, X là magnesium (Mg) và Y là calcium (Ca).
Trường hợp 2: ZY – ZX = 18 (3)
Kết hợp (1) và (3) giải hệ phương trình ta được: ZX = 7; ZY = 25.
Cấu hình electron của X: 1s22s22p3 (nhóm VA)
Cấu hình electron của Y: 1s22s22p63s23p63d54s2 (nhóm VIIB)
Vậy trường hợp 2 không thỏa mãn.
Trường hợp 3: ZY – ZX = 32 (4)
Kết hợp (1) và (4) giải hệ phương trình ta được: ZX = 0; ZY = 32.
Vậy trường hợp 3 không thỏa mãn.
Kim loại M thuộc nhóm IIA của bảng tuần hoàn, là một thành phần dinh dưỡng quan trọng. Cho 1,8 gam M tác dụng hết với dung dịch HCl, thu được 1,11555 lít khí (đkc). M là kim loại nào sau đây?
nH2 = 1,11555: 24,79 = 0,045 mol
M + 2HCl → MCl2 + H2↑
Theo phương trình phản ứng ta có:
nM = nH2 = 0,045 mol
M chính là nguyên tố Ca
Nguyên tử Y có 19 proton. Khi hình thành liên kết hóa học Y có xu hướng hình thành ion có cấu hình electron là
Nguyên tử Y có 19 proton ⇒ ZY = số proton = 19
Cấu hình electron của Y: 1s22s22p63s23p64s1
⇒ có 1 electron lớp ngoài cùng, xu hướng nhường đi 1 electron để đạt được cấu hình electron của khí hiếm gần nhất là Ar.
Do đó ion được tạo thành từ Y có cấu hình electron là: 1s22s22p63s23p6
Để đạt được quy tắc octet, nguyên tử nitrogen (Z= 7) phải nhận thêm?
Nitrogen (Z= 7) có cấu hình electron là: 1s22s22p3
→ Có 5 electron lớp ngoài cùng.
Khí hiếm gần nhất là: Ne (Z = 10): 1s22s22p6
Do đó, nguyên tử nitrogen phải nhận thêm 3 electron để đạt được cấu hình electron bền vững với 8 electron lớp ngoài cùng theo quy tắc octet.
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10 electron là:
Na có Z = 11 số e = 11
ion Na+ có số e = 11 – 1 = 10
Mg có Z = 12 số e = 12
ion Mg2+ có số e = 12 – 2 = 10
Al có Z = 13 số e = 13
ion Al3+ có số e = 13 – 3 = 10
Ca có Z = 20 số e = 20
ion Ca2+ có số e = 20 – 2 = 18
S có Z = 16 số e = 16
ion S2- có số e = 16 + 2 = 18
Cl có Z = 17 số e = 17
ion Cl- có số e = 17 + 1 = 18
O có Z = 8 số e = 8
ion O2- có số e = 8 + 2 = 10
Vậy có 4 ion có 10 electron.
Hầu hết các hợp chất ion
- Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
- Các hợp chất ion thường tan nhiều trong nước. Khi tan trong nước, các ion bị tách ra khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
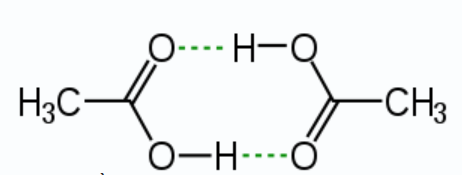
Trong sơ đồ trên, đường nét đứt đại diện cho
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Trong sơ đồ trên, đường nét đứt đại diện cho liên kết hydrogen.
Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy xác định câu sai trong các câu sau khi nói về nguyên tử X.
Hạt nhân nguyên tử không chứa electron.
Dãy nào sau đây sắp xếp theo thứ tự giảm dần tính base?
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
11 Na, 12Mg, 13Al, 14Si cùng thuộc chu kì 2.
⇒ Sắp xếp theo thứ tự giảm dần tính base là: NaOH; Mg(OH)2; Al(OH)3; Si(OH)4.
Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Xác định nguyên tử khối trung bình của X?
Các loại hạt trong X1 bằng nhau
⇒ pX1 = eX1 = nX1 = 18:3 = 6
Vì X1 và X2 là đồng vị của nhâu
⇒ pX1 = pX2 = 6
Tổng số hạt trong X2 là 20
⇒ 2pX2 + nX2 = 20
⇒ nX2 = 8
⇒ Số khối của X1 = pX1 + nX1 = 6 + 6 = 12
Số khối của X2 = pX2 + nX2 = 6 + 8 = 14
Nguyên tử khối trung bình của X là:
