Phương trình phản ứng oxi hoá - khử là phương trình nào dưới đây?
Phương trình Fe + 3AgNO3 → Fe(NO3)3 + 3Ag vì có sự thay đổi số oxi hóa Fe lên Fe+3 và Ag+ xuống Ag
Phương trình phản ứng oxi hoá - khử là phương trình nào dưới đây?
Phương trình Fe + 3AgNO3 → Fe(NO3)3 + 3Ag vì có sự thay đổi số oxi hóa Fe lên Fe+3 và Ag+ xuống Ag
Trong phản ứng: 2KOH + Cl2 → KClO + KCl + H2O. Vai trò của Cl2 là
Cl2 vừa có tính oxi hóa vừa có tính khử
2KOH + Cl02 → KCl-1O + KCl+1 + H2O
Số mol electron cần có để khử 0,5 mol N+5 thành N-3 là
N+5 + 8e → N-3
0,5 → 4 (mol)
Trong phản ứng: K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O. Số phân tử HCl đóng vai trò chất khử bằng x lần tổng số phân tử HCl tham gia phản ứng. Giá trị của x là bao nhiêu?
3x 2x | 2Cl-1 → Cl20 + 2e Cr+6 + 3e → Cr+3 |
Phương trình phản ứng
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
14 phân tử HCl thì có (6 phân tử HCl đóng vai trò chất khử, còn lại 8 phân tử đóng vai trò là môi trường)
Số phân tử HCl đóng vai trò chất khử : tổng số phân tử HCl phản ứng
6/14 = 3/7
Dấu hiệu để nhận ra một phản ứng oxi hóa - khử là
Dấu hiệu để nhận ra một phản ứng oxi hóa - khử là có sự thay đổi số oxi hóa của một hay một số nguyên tố.
Trong phản ứng : 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O. NO2 đóng vai trò là:
Trong phản ứng trên N trong NO2 đều có sự tăng giảm số oxi hóa nên NO2 vừa là chất oxi hoá vừa là chất khử.
Nhận định nào sau đây đúng?
Sự oxi hóa là sự mất (nhường) electron.
Cho 22 g hỗn hợp Fe, Al tác dụng hết với dung dịch HNO3 loãng thu được 13,44 lít khí NO (đktc) và dung dịch chứa Fe(NO3)3; Al(NO3)3. Khối lượng Al là bao nhiêu?
nNO = 0,6 mol
Gọi số x, y lần lượt là số mol của Fe, Al
Ta có: 56x + 27y = 22 (1)
Quá trình trao đổi e:
Quá trình nhường e Fe0 → Fe+3 + 3e x → 3x Al0 → Al+3 + 3e y → 3y | Quá trình nhận e N+5 + 3e → N+2 1,8 ← 0,6 |
Áp dụng định luật bảo toàn e ta có
3x + 3y = 1,8 (2)
Giải hệ phương trình (1); (2)
x = 0,2; y = 0,4
mAl = 0,4.27 = 10,8 gam.
Cho các phản ứng sau:
(1) Zn + 2HCl → ZnCl2 + H2
(2) FeCl2 + Zn → ZnCl2 + Fe
(3) CuCl2 + 2NaOH → NaCl + Cu(OH)2
(4) 2Fe + 3Cl2 → 2FeCl3
(5) HNO3 + KOH → KNO3 + H2O
Các phản ứng có sự trao đổi electron là:
(1) Zn + 2HCl → ZnCl2 + H2
(2) FeCl2 + Zn → ZnCl2 + Fe
(4) 2Fe + 3Cl2 → 2FeCl3
Hòa tan 7,5 gam hỗn hợp Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 7,84 lít khí H2 (đktc) và dung dịch muối. Khối lượng của Mg trong hỗn hợp đầu là bao nhiêu gam?
nH2 = 7,84 : 22,4 = 0,35 mol
Gọi số mol của Mg, Al lần lượt là x, y
Ta có:
24x + 27y = 7,5 (1)
Phương trình phản ứng
Mg + 2HCl → MgCl2 +H2
x → x → x mol
2Al + 6HCl → 2AlCl3 + 3H2
y → y →3y/2 mol
Theo phương trình ta có:
x + 3y/2 = 0,35 (2)
Giải hệ phương trình (1), (2) ta có
x = 0,2; y = 0,1
nMg = x = 0,2 mol => mMg = 0,2.24 = 4,8 gam.
Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dN2O + eH2O. Các hệ số a, b, c, d, e là những số nguyên tối giản. Tổng (d + e) bằng bao nhiêu?
Phương trình phản ứng
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
d: N2O
e: H2O
Tổng (d +e) = 3 + 15 = 18
Cho phản ứng: Mg + HNO3 → Mg(NO3)2 + NO + H2O. Tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là:
Phương trình phản ứng cân bằng:
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O.
Cho phản ứng sau:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
Phương trình phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Chất oxi hóa là KMnO4
Chất khử là FeSO4
Trong phản ứng: aFe + bH2SO4 đặc → cFe2(SO4)3 + dSO2 + eH2O. Các hệ số nguyên, tối giản a, b, c, d, e trong phương trình hóa học trên lần lượt là dãy số nào?
Quan sát phương trình phản ứng ta thấy Fe tăng từ mức oxi hóa 0 lên mức oxi hóa +3; S giảm từ mức oxi hóa +6 xuống mức oxi hóa +4 Fe là chất khử và H2SO4 là chất oxi hóa.
Phương trình hóa học:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Trong các phản ứng dưới đây, phản ứng nào không phải là phản ứng oxi hoá - khử?
FeS + 2HCl → FeCl2 + H2S vì không có sự thay đổi số oxi hóa.
Cho sơ đồ phản ứng sau: Al + HNO3 → Al(NO3)3 + N2 + H2O. Hệ số cân bằng của phản ứng lần lượt là:
Xác định vai trò của từng chất tham gia phản ứng và nêu sự oxi hóa, sự khử:
Al0 + H+5NO3loãng → Al+3(NO3)3+ N02+ H2O
Số oxi hóa của Al tăng từ 0 lên +3 ⇒ Al là chất khử
Số oxi hóa của N giảm từ +5 xuống 0 ⇒ HNO3 là chất oxi hóa
Sự oxi hóa: Al → Al+3 + 3e
Sự khử: 2N+5 + 10e → N2
b) Cân bằng phản ứng trên theo phương pháp thăng bằng electron.
0Al + H+5NO3 loãng → Al+3(NO3)3+ 0N2 + H2O
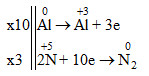
Phương trình phản ứng
10Al + 36HNO3 loãng → 10Al(NO3)3 + 3N2 + 18H2O
Trong các phản ứng: Fe + CuSO4 → FeSO4 + Cu. Chất bị oxi hóa là
Quá trình nhường electron là sự oxi hóa, quá trình nhận electron là
Fe + CuSO4 → FeSO4 + Cu
Fe → Fe2+ +2e (sự oxi hóa)
Cu2++ 2e → Cu (sự khử)
Trong các phản ứng: 3C + 2KClO3 → 2KCl + 3CO2. Chất bị oxi hóa là
Sự thay đổi số oxi hóa
C là chất khử hay là chất bị oxi hóa.
Cho sơ đồ phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O. Sau khi cân bằng, hệ số của phân tử các chất là phương án nào sau đây?
Phương trình phản ứng:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
Hệ số của phân tử các chất cân bằng lần lượt là: 3; 28; 9; 1; 14
Cho sơ đồ phản ứng sau: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hóa và môi trường trong phản ứng là:
Xác định sự thay đổi số oxi hóa
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
Ta có :
3x 1x | Fe+2 → Fe+3 + 1e N+5 + 3e → N+2 |
Phương trình phản ứng
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Trong 10 phân tử HNO3 phản ứng, có 1 phân tử là chất oxi hóa tạo NO, 9 phân tử làm môi trường tạo muối Fe(NO3)3
