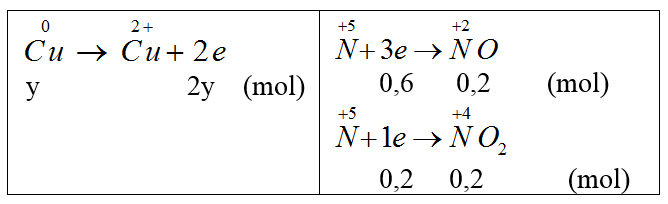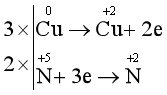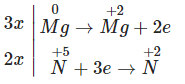Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, chỉ thu được sản phẩm khử là 0,896 lít (đktc) hỗn hợp khí gồm NO và N2, có tỉ khối so với H2 bằng 14,75. Thành phần phần trặ theo khối lượng của sắt trong hỗn hợp ban đầu là:
nNO = x mol, nH2 = y mol
(1)
30x + 28y = mhh = 14,75.2.0,04 (2)
Từ (1) và (2) ta có x = 0,03, y = 0,01 (mol)
Gọi nFe = a mol, nMg = b mol.
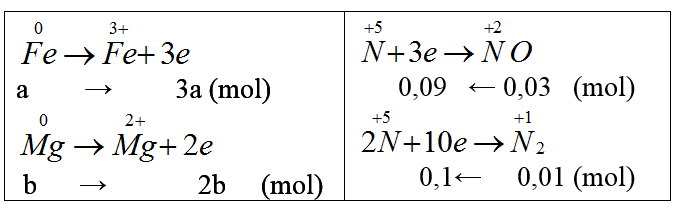
Ta có: 56a + 24b = 2,64 (3)
Bảo toàn electron: 3a + 2b = 0,19 (4)
Từ (3) và (4) ta có: a = 0,018 mol; b = 0,068 mol.