Thứ tự giảm dần tính base là
11 Na, 12Mg, 13Al, 14Si cùng thuộc chu kì 2.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính base của oxide cao nhất có xu hướng giảm dần.
⇒ Thứ tự giảm dần tính base là: Na2O > MgO > Al2O3 > SiO2.
Thứ tự giảm dần tính base là
11 Na, 12Mg, 13Al, 14Si cùng thuộc chu kì 2.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính base của oxide cao nhất có xu hướng giảm dần.
⇒ Thứ tự giảm dần tính base là: Na2O > MgO > Al2O3 > SiO2.
Oxide nào sau đây tạo ra môi trường acid khi cho vào nước?
SO3 là oxide acid nên tạo ra môi trường acid khi cho vào nước.
Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
Ta có 1s22s22p5 là cấu hình electron của F (Z = 9), đây là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn (3,98).
Dãy các nguyên tố nào sau đây có tính kim loại giảm dần?
| Nhóm IIA | Nhóm IIIA | Nhóm IVA | Nhóm VA | |
| Chu kì 2 | N | |||
| Chu kì 3 | Al | Si | P | |
| Chu kì 4 | ||||
| Chu kì 5 | Sr |
Dựa vào quy luật biến đổi tính kim loại trong một chu kì và trong một nhóm A, ta có tính kim loại giảm dần theo thứ tự: Sr > Al > Si > P > N.
Dãy nguyên tử nào sau đây có bán kính tăng dần?
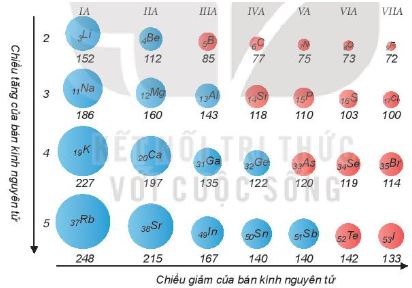
Theo quy luật biến đổi bán kính trong 1 chu kì và nhóm có bán kính các nguyên tử tăng dần theo thứ tự: F < S < Si < Ge < Ca < Rb.
Phát biểu nào sau đây không đúng?
Chu kì 1 có hai nguyên tố là H (Z = 1) và He (Z = 2).
⇒ He (Z = 2) có bán kính nhỏ hơn H (Z = 1)
⇒ Phát biểu "Nguyên tử có bán kính nhỏ nhất có Z = 1" là sai
Cho các nguyên tố sau: F, Cl, Br, I. Nguyên tử của nguyên tố có bán kính bé nhất là
F (Z = 9), Cl (Z = 17), Br (Z = 35), I ( Z = 53) cùng thuộc nhóm VIIA
Trong 1 nhóm A, bán kính nguyên tử giảm dần theo chiều tăng dần của điện tích hạt nhân
⇒ Bán kính F < Cl < Br < I
Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
Các đại lượng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử gồm:
Số electron lớp ngoài cùng, bán kính nguyên tử, độ âm điện, tính kim loại – phi kim.
Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d1. Tổng số electron của nguyên tử nguyên tố X là
Electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d1
Sắp xếp lại: 1s22s22p63s23p63d14s2
⇒ Tổng số electron của nguyên tử nguyên tố X là 21
Cho cấu hình electron các nguyên tố sau đây: [Ar]3d54s1. Nguyên tố thuộc khối nguyên tố nào?
Nguyên tố d là nguyên tố nhóm B mà nguyên tử có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng là (n –1)d1÷10ns1÷2.
Cấu hình electron: [Ar]3d54s1
Thuộc nguyên tố thuộc khối d.
Cấu hình electron của nguyên tử chlorine là 1s22s22p63s23p5. Vị trí của chlorine trong bảng tuần hoàn là:
Cấu hình electron của nguyên tử chlorine là 1s22s22p63s23p5
Chlorine có 17 electron nên Z = 17, chlorine ở ô số 17 trong bảng tuần hoàn.
Chlorine ở chu kì 3 (do có 3 lớp electron);
nhóm VIIA (do 7 electron hóa trị, nguyên tố p).
Cho các cấu hình electron của một số nguyên tử nguyên tố, nguyên tố thuộc kim loại là:
Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
Vậy 1s22s22p63s23p63d14s2 là nguyên tố kim loại
Cấu hình electron của F- tương ứng là:
F (Z = 9) có cấu hình electron: 1s22s22p5
F nhận 1 electron để tạo thành ion F-.
Cấu hình electron của F- là: 1s22s22p6.
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
Mỗi AO chứa tối đa 2 electron, như vậy nếu 5 electron được điền vào 3 AO thì sẽ có 2 AO đã chứa đủ electron tối đa, 1AO chỉ chứa 1 electron (electron độc thân).
Nguyên tử O có 8 electron. Theo mô hình Rutherford – Bohr, nguyên tử O có số electron có cùng năng lượng ở lớp thứ nhất là
O có số electron tối đa ở lớp thứ nhất là: 2.
Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s. Viết cấu hình electron của nguyên tử A.
Nguyên tử A có electron ở phân lớp 3d nên phân lớp 4s của A đã bão hòa (với 2 electron). Vậy số electron trên phân lớp 3d của A là 1.
Cấu hình electron nguyên tử A: 1s22s22p63s23p63d14s2.
Nguyên tử của nguyên tố oxygen có 3 đồng vị là: ![]() ;
; ![]() ;
; ![]() với % số nguyên tử tương ứng là a, b, c. Trong đó a = 15b và a - b = 21c. Số khối trung bình của các đồng vị trên là:
với % số nguyên tử tương ứng là a, b, c. Trong đó a = 15b và a - b = 21c. Số khối trung bình của các đồng vị trên là:
Theo đề bài ta có:
Số khối trung bình của các đồng vị trên là:
Nguyên tố Bo có 2 đồng vị bền là 11B (x1 %) và 10B (x2 %), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1 % là:
Nguyên tử khối trung bình của Bo là 10,8
(1)
x1 + x2 = 100 (2)
Từ (1) và (2) giải hệ được:
x1 = 80; x2 = 20
Nguyên tử ![]() có tổng số hạt mang điện nhiều hơn số hạt không mang điện là:
có tổng số hạt mang điện nhiều hơn số hạt không mang điện là:
Ta có Z = P = E = 35
⇒ Tổng số hạt mang điện là: 35 + 35 = 70
Số khối A = N + Z = 80 ⇒ N = 45
Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 70 - 45 = 25 (hạt)
Nguyên tử nitrogen có 7 neutron, số khối là 14. Điện tích hạt nhân của nguyên tử neutrogen
Nguyên tử nitrogen có số proton = số electron = 7.
Điện tích hạt nhân nguyên tử là: +7.
Biết tổng số hạt p, n, e trong nguyên tử nguyên tố là 155 hạt. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Số khối A là:
Theo tổng số hạt: 2Z + N = 115 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt
2Z - N = 33 (2)
Giải hệ phương trình (1) và (2) ta được: Z = 35 và N = 45
Số khối A là A = Z + N = 80
Trong một phân tử HNO3 có bao nhiêu nguyên tử?
Trong một phân tử HNO3 có 5 nguyên tử
Trong tự nhiên, oxygen có 3 đồng vị là 16O,17O, 18O. Có bao nhiêu loại phân tử O2?
Có 6 loại phân tử O2 là: 16O – 16O; 16O – 17O; 16O – 18O; 17O – 17O; 17O – 18O; 18O – 18O;
Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
Cả 4 phát biểu đều đúng
Bán kính nguyên tử và khối lượng mol nguyên tử iron lần lượt là 1,28 ![]() và 56 g/mol. Tính khối lượng riêng của iron. Biết rằng trong tinh thể, các tinh thể iron chiếm 74% thể tích, còn lại là phần rỗng.
và 56 g/mol. Tính khối lượng riêng của iron. Biết rằng trong tinh thể, các tinh thể iron chiếm 74% thể tích, còn lại là phần rỗng.
Đổi 1,28 = 1,28.10 -8 cm.
Khối lượng của 1 nguyên tử Fe:
Thể tích của 1 nguyên tử Fe:
≈
Khối lượng riêng của iron:
≈ 10,59 (g/cm3)
Do Fe chiếm 74% thể tích trong tinh thể nên khối lượng riêng thực tế của Fe là:
10,59.74:100 = 7,84 (g/cm3)
Magnesium oxide (MgO) có tổng số hạt mang điện trong hợp chất MgO là 40. Số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8. Điện tích hạt nhân của Mg và O lần lượt là:
Tổng số hạt mang điện trong hợp chất MgO là 40 nên:
(pMg + eMg) + (pO + eO) = 40 hay 2pMg + 2pO = 40 (1)
Lại có, số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8 nên:
(pMg + eMg) - (pO + eO) = 8 hay 2pMg - 2pO = 8 (2)
Từ (1) và (2) giải hệ phương trình ta được: pMg = 12 và pO = 8.
Vậy điện tích hạt nhân Mg là +12; điện tích hạt nhân O là +8.
Thành phần nào không bị lệch hướng trong trường điện?
Nguyên tử hydrogen trung hòa về điện nên không bị lệch hướng trong trường điện.
Thí nghiệm phát hiện ra electron là:
Thí nghiệm phát hiện ra electron là phóng điện giữa hai điện cực có hiệu điện thế 15 kV đặt trong chân không (áp suất khoảng 0,001mmHg).
Cho 5,85 gam muối NaX tác dụng với dung dịch AgNO3 dư thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X (x1%) và 37X (x2%). Vậy giá trị của x1% và x2% lần lượt là:
Khi cho NaX vào AgNO3 thu được kết tủa AgX
Ta có: NaX + AgNO3 → AgX ↓ + NaNO3
Ta có: nNaX = nAgX
MX = 35,5
Nguyên tử khối trung bình của X được tính theo công thức sau:
(1)
Mặt khác: x1 + x2 = 100 (2)
Giải hệ (1) và (2) ta có x1 = 75 và x2 = 25
Hợp chất MCl2 có tổng số hạt cơ bản là 164. Trong hợp chất, số hạt mang điện nhiều hơn số hoạt không mang điện là 52. Công thức của hợp chất trên là :
Vì tổng số hạt là 164 nên:
(2p + n) + (2.(17.2+18)) = 164
2p + n = 60 (1)
- Số hạt mang điện nhiều hơn số hoạt không mang điện là 52:
(2p + 2.17.2) - (n + 2.18) = 52
2p - n = 20 (2)
Từ (1) và (2) ta có hệ phương trình:
M là nguyên tố Ca
Công thức của hợp chất là CaCl2.
A, B, C là các kim loại chuyển tiếp và đều thuộc chu kỳ 4 trong bảng tuần hoàn (ZA < ZB < ZC). Biết rằng tổng số electron lớp ngoài cùng của A, B và C bằng 4; tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng của B là 8. Điều khẳng định nào sau đây về A, B, C là đúng?
Cấu hình electron của A, B, C có dạng: [Ar]3dα4sa4pb
Do tổng số electron lớp ngoài cùng của A, B, C bằng 4 nên phải có 2 nguyên tố có cấu hình electron lớp ngoài cùng dạng 4s1 và 1 nguyên tố còn lại 4s2
Vì B có tổng số electron lớp ngoài cùng và phân lớp sát ngoài cùng là 8 nên B có cấu hình: [Ar]3d64s2
Vậy A là: [Ar]3d54s1 và C là: [Ar]3d104s1
A: 24Cr; B: 26Fe; C: 29Cu
số electron của B2+ là 24; số electron của C2+ là 27
Tổng số electron của B2+ và C2+ là 51.
Công thức oxide cao nhất của Cr là CrO3.
Tổng số proton trong A, B, C là: 24 + 26 + 29 = 79 nên tổng số khối của A, B, C > 79
Cu không tác dụng được với dung dịch H2SO4 loãng.
Nguyên tố X ở chu kì 3, nhóm IIIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
Nguyên tố X ở chu kì 3 ⇒ Có 3 lớp electron.
Nguyên tố X thuộc nhóm IIIA ⇒ Lớp ngoài cùng có 3 electron.
⇒ 1s22s22p63s23p1
Biết rằng các nguyên tố X, Y lần lượt nằm ở chu kì 3 và 2 trong bảng tuần hoàn. Tổng số electron lớp ngoài cùng trong nguyên tử của nguyên tố X và Y là 12. Ở trạng thái cơ bản số electron p của X nhiều hơn của Y là 8. Vậy X và Y thuộc nhóm nào?
X ở chu kì 3, Y ở chu kì 2 ⇒ X có 3 lớp electron, Y có 2 lớp electron, số electron tối đa ở lớp ngoài cùng là 8.
Ở trạng thái cơ bản số electron p của X nhiều hơn của Y là 8:
⇒ pX − pY = 8 (1)
Tổng số electron lớp ngoài cùng của X và Y là 12 ⇒ electron cuối cùng được điền vào phân lớp p và (pX − 6 + 2) + pY + 2 = 12
⇔ pX + pY = 14 (2)
Từ (1) và (2) ta có pX = 11, pY = 3.
Vậy cấu hình của X là: 1s22s22p63s23p5. Vị trí của X trong bảng tuần hoàn: ô 17, nhóm VIIA.
Cấu hình electron của Y là: 1s22s22p3. Vị trí của Y trong bảng tuần hoàn: ô 7, nhóm VA.
Đa số các nguyên tố được xếp theo cột trong bảng tuần hoàn hóa học có
Đa số các nguyên tố được xếp theo cột trong bảng tuần hoàn hóa học có tính chất hóa học gần giống nhau do có cấu hình electron tương tự nhau.
Cho cấu hình electron của các nguyên tố A1, A2, A3, A4 như sau
A1 : 1s22s22p63s1
A2 :1s22s22p63s23p1
A3 :1s22s22p63s23p64s2
A4 :1s22s22p63s2
Các nguyên tố kim loại cùng nhóm gồm có
Các nguyên tố kim loại là các nguyên tố có số electron lớp ngoài cùng là 1, 2, 3 (trừ H, He, B).
Các nguyên tố cùng nhóm là các nguyên tố có cùng số electron hóa trị.
Có A3 và X4 cùng là kim loại thuộc nhóm IIA.
Nguyên tố M ở chu kì 3, nhóm IA. Nguyên tố G ở chu kì 2, nhóm VIA. Vậy tổng số proton trong hạt nhân nguyên tử M và G là
Nguyên tố M ở chu kì 3, nhóm IA có cấu hình e: 1s22s22p63s1
Nguyên tố G ở chu kì 2, nhóm VIA có cấu hình e: 1s22s22p4
Tổng số p = 11 + 8 = 19
Cation R+ có cấu hình electron phân lớp ngoài cùng là 3p6. Vị trí của R trong bảng tuần hoàn là
Cation R+ có cấu hình electron phân lớp ngoài cùng là 3p6 cấu hình e của R+ là : 1s22s22p63s23p6
cấu hình e của R là: 1s22s22p63s23p64s1
R thuộc ô thứ 19, nhóm IA, chu kỳ 4.
Các nguyên tố thuộc dãy nào sau đây được sắp xếp theo chiều tăng dần của điện tích hạt nhân?
Ta có: ZC = 6, ZN = 7, ZO = 8
Dãy sắp xếp đúng là: C, N, O.
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn các nguyên tố hoá học. Oxide của X tan trong nước tạo thành một dung dịch làm quỳ tím hoá đỏ. Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh. Oxide của Z phản ứng được với cả acid lẫn kiềm. Dãy các nguyên tố được sắp xếp theo chiều tăng dần số hiệu nguyên tử từ trái sang phải là
- Oxide của X tan trong nước tạo thành dung dịch làm quỳ tím hoá đỏ Hydroxide của X có tính acid
X là 1 phi kim
- Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh Hydroxide của Y có tính base
Y là một kim loại
- Z phản ứng được với cả acid lẫn kiềm và X, Y, Z thuộc cùng 1 chu kì Tính kim loại giảm dần theo thứ tự Y, Z, X
- Theo bài có X, Y, Z thuộc cùng 1 chu kì. Theo quy luật tuần hoàn, theo chiều tăng dần số hiệu nguyên tử thì tính kim loại tăng dần
Thứ tự tăng dần số hiệu nguyên tử là Y, Z, X.
Trong một chu kì của bảng tuần hoàn khi đi từ trái sang phải thì:
Trong một chu kì của bảng tuần hoàn khi đi từ trái sang phải thì bán kính nguyên tử giảm dần.
