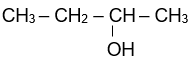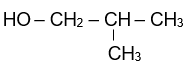Alcohol
I. Khái niệm và cấu trúc
| CH3–CH2–OH | CH2=CHCH2–OH | 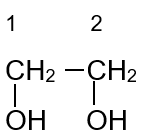 |
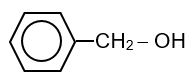 |
| ethanol | prop-en-1-ol | Ethane-1,2-diol | phenylmathanol |
Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no.
- Alcohol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH (n ≥ 1).
Ví dụ: CH3–OH, C2H5–OH, C3H7 –OH, ...
- Alcohol có nhiều hơn 1 nhóm –OH gọi là polyalcohol.
Ví dụ:
 |
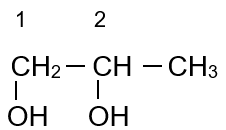 |
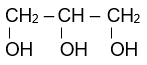 |
| Ethane-1,2-diol | propane-1,2-diol | propane-1-2-3-triol |
- Bậc alcohol là bậc của nguyên tử carbon liên kết với nhóm –OH.
| CH3–CH2–OH | 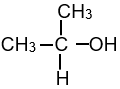 |
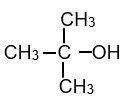 |
| Alcohol bậc I | Alcohol bậc II | Alcohol bậc III |
 |
 |
| Mô hình phân tử CH3OH (Methanol) | Mô hình phân tử C2H5OH (Ethanol) |
II. Đồng phân và danh pháp
1. Đồng phân
Các alcohol no, đơn chức, mạch hở trong phân tử có từ 3 nguyên tử carbon trở lên có đồng phân vị trí nhóm –OH, có từ nguyên tử 4 carbon trở lên có thêm đồng phân mạch carbon.
Ví dụ: Cho công thức phân tử C4H10O. Số đồng phân cấu tạo alcohol tương ứng là:
|
CH3CH2CH2CH3-OH butan-1-ol |
butan-2-ol |
|
2-methylpropan-1-ol |
2-methylpropan-2-ol |
2. Danh pháp
- Tên theo danh pháp thay thế của alcohol đơn chức:

Ví dụ:
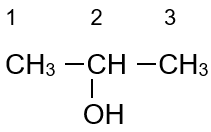
propan-2-ol
- Tên theo danh pháp thay thế của alcohol đa chức:
Ví dụ:

propane-1-2-3-triol
III. Tính chất vật lý
- Ở điều kiện thường, các alcohol tồn tại ở thể lỏng hoặc thể rắn.
- Nhiệt độ sôi tăng khi phân tử khối tăng
- Polyalcohol có nhiệt độ sôi cao hơn alcohol đơn chức có phân tử khối tương đương.
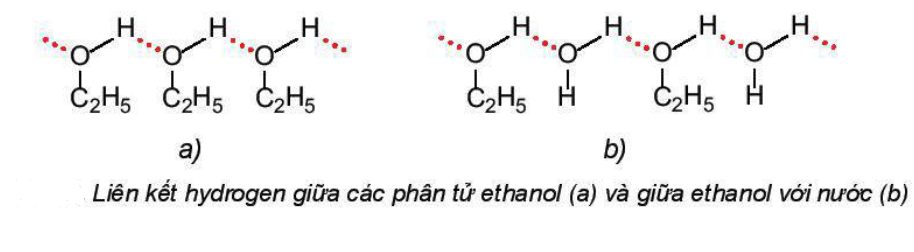
- Do các phân tử alcohol có liên kết hydrogen liên phân tử nên có nhiệt độ sôi cao hơn hydrocarbon hoặc ether có phân tử khối tương đương.
- Do tạo liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng.
IV. Tính chất hóa học
Trong phân tử alcohol, liên kết C-O và O-H phân cực về phía nguyên tử oxygen, 2 liên kết này quyết định các tính chất hóa học của alcohol.
1. Phản ứng thế nguyên tử H của nhóm –OH
Alcohol có phản ứng thế nguyên từ hydrogen của nhóm –OH
R(OH)n +nNa → R(ONa)n + ![]() H2
H2
Ví dụ
2C2H5OH + 2Na → 2C2H5ONa + H2
2. Phản ứng tạo ether
Phản ứng giữa hai phân tử alcohol tạo ehter
ROH + OHR' ![]() ROR' + H2O
ROR' + H2O
C2H5OH + HOC2H5 ![]() C2H5-O-C2H5 + H2O
C2H5-O-C2H5 + H2O
3. Phản ứng tạo thành alkene
Phản ứng tách nước từ alkanol tạo alkene
CnH2n+1OH ![]() CnH2n + H2O
CnH2n + H2O
Ví dụ:
CH3CH2OH ![]() CH2 = CH2 + H2O
CH2 = CH2 + H2O
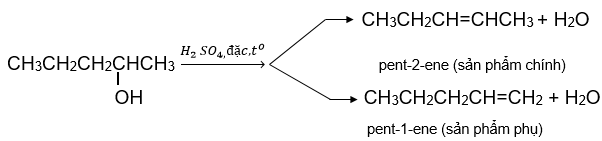
Có thể dự đoán sản phẩm chính, phụ của phản ứng dựa vào quy tắc Zaitsev.
Trong phản ứng tách nước của alcohol, nhóm – OH bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
4. Phản ứng oxi hóa alcohol
4.1. Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
Alcohol + oxygen → carbon dioxide + nước
Ví dụ:
C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(g)
2CO2(g) + 3H2O(g)
4.2. Phản ứng oxi hóa không hoàn toàn
Trong điều kiện thích hợp, một số alcohol bị oxi hóa không hoàn toàn thành aldehyde hoặc ketone.
![]()
| alcohol bậc I | aldehyde |
Ví dụ:
CH3CH2OH + CuO ![]() CH3CHO + Cu + H2O
CH3CHO + Cu + H2O
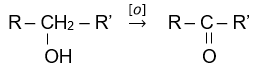
| alcohol bậc II | ketone |
Ví dụ:
CH3-CH(OH)-CH3 + CuO ![]() CH3-CO-CH3 + Cu + H2O
CH3-CO-CH3 + Cu + H2O
Trong điều kiện trên, alcohol bậc III không phản ứng.
5. Phản ứng riêng của polyalcohol
Các polyalcohol có các nhóm –OH liền kề như ethylene glycol, glycerol,.. có thể tạo phức chất với Cu(OH)2, sản phẩm có màu xanh đặc trưng.
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]Cu + 2H2O
| Glycerol | Copper (II) glycerate |
V. Ứng dụng và điều chế
1. Ứng dụng
Methanol, ethanol là dung môi phổ biến cho nhiều ngành công nghiệp có chi phí thấp và ít độc hại hơn các dẫn xuất halogen.
Dùng làm nhiên liệu cho động cơ đốt trong, chất trung gian để tổng hợp chất hữu cơ, ...
Glycerol được dùng trong các lĩnh vực thực phẩm và đồ uống, sử dụng trong y tế, dược mỹ phẩm.
Lạm dụng đồ uống có cồn sẽ gây hại cho sức khỏe, các bệnh về gan, huyết áp, dạ dày, cũng như hệ thần kinh, gây tai nạn khi tham gia giao thông.

2. Điều chế
Ethanol được điều chế bằng phản ứng hợp nước của ethylene hoặc lên men tinh bột:
CH2 = CH2 + H2O ![]() CH3 – CH2 – OH
CH3 – CH2 – OH
Điều chế ethanol bằng phương pháp sinh hoá
Khi lên men tinh bột, enzyme sẽ phân giải tinh bột thành glucose, sau đó glucose sẽ chuyển hoá thành ethanol:
(C6H10O5)n + nH2O ![]() nC6H12O6
nC6H12O6
tinh bột glucose
C6H12O6 ![]() 2C2H5OH + 2CO2
2C2H5OH + 2CO2
glucose
Glycerol được điều chế từ propylene hoặc chất béo: