Alkane
I. Khái niệm về alkane
Alkane là những hydrocarbon mạch hở chỉ chứa liên kết đơn trong phân tử và có công thức chung là CnH2n+2 (n≥1).
Ví dụ:
Ethane (C2H6)
Propane (C3H8)
Butane (C4H10)
Nguồn alkane trong tự nhiên: dầu mỏ, khí dầu mỏ, khí ao hồ.
Cấu tạo và công thức của alkane
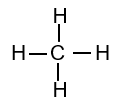 |
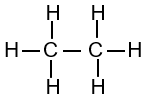 |
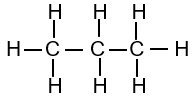 |
| Methane | Ethane | Propane |
Alkane không phân nhanh có mạch carbon chỉ chứa nguyên tử carbon bậc I và bậc II. Alkane phân nhánh có chứa nguyên tử carbon bậc III, IV.
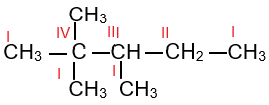
Bậc của nguyên tử carbon trong phân tử alkane được xác định bằng số nguyên tử carbon liên kết trực tiếp với nguyên tử carbon đó. Bậc của nguyên tử carbon được kí hiệu bằng số La Mã.
II. Danh pháp
1. Tên theo danh pháp thay thế của alkane không phân nhánh

Tên thay thế của một số alkane mạch không nhánh
| Số nguyên tử carbon | Công thức alkane | Phần nền | Tên alkane |
| 1 | CH4 | meth- | methane |
| 2 | CH3CH3 | eth- | ethane |
| 3 | CH3CH2CH3 | prop- | propane |
| 4 | CH3[CH2]2CH3 | but- | butane |
| 5 | CH3[CH2]3CH3 | pent- | pentane |
| 6 | CH3[CH2]4CH3 | hex- | hexane |
| 7 | CH3[CH2]5CH3 | hept- | heptane |
| 8 | CH3[CH2]6CH3 | oct- | octane |
| 9 | CH3[CH2]7CH3 | non- | nonane |
| 10 | CH3[CH2]8CH3 | dec- | decane |
2.2. Tên theo danh pháp thay thế của alkane phân nhánh

- Chọn mạch chính là mạch carbon dài nhất.
- Đánh số nguyên tử carbon mạch chính sao cho mạch nhánh có số chỉ vị trí nhỏ nhất.
- Tên nhánh là tên gốc alkyl. Gốc alkyl là phần còn lại sau khi loại đi 1 nguyên tử H của alkane
- Dùng chữ số (1, 2, 3, ...) và gạch nối (-) để chỉ vị trí nhánh, nhóm cuối cùng viết liền với tên mạch chính.
- Nếu có nhiều nhánh giống nhau: dùng các từ như di-(2), tetra-(4),... để chỉ số lượng nhóm giống nhau, tên nhanh viết theo thứ tự bảng chữ cái.
Ví dụ:
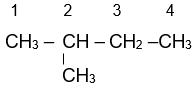 |
 |
| 2-methylbutane | 2-2-dimethylpropane |
Tên gốc alkyl được gọi theo tên alkane nhưng bỏ ane thêm yl (thay đuôi ane trong alkane bằng yl)
Ví dụ: methyl CH3-, ethyl (C2H5-), propyl (C3H7-), ...
III. Tính chất vật lí
Ở điều kiện thường, các alkane từ C1 đến C4 ở thể khí.
Các alkane đều nhẹ hơn hơn nước, không tan truong nước, nhưng tan trong các dung môi không phân cực.
Khi số nguyên tử carbon tăng, nhiệt độ sôi và nhiệt độ nóng chảy của các alkane tăng.
IV. Tính chất hóa học
Do phân tử chỉ chứa liên kết σ bền, không phân cực nên alkane tương đối trơ về mặt hóa học.
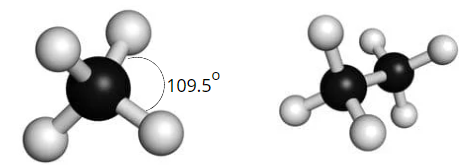 Mô hình phân tử methane và ethane
Mô hình phân tử methane và ethane
1. Phản ứng thế halogen
CnH2n+2 + Cl2 ![]() CnH2n+1 + HCl
CnH2n+1 + HCl
Trộn methane với chlorine và chiếu ánh sáng tử ngoại, sản phẩm thu được là chloromethane.
CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
Chloromethane
CH3Cl + Cl2 ![]() CH2Cl2 + HCl
CH2Cl2 + HCl
dichloromethane
CH2Cl2 + Cl2 ![]() CHCl3 + HCl
CHCl3 + HCl
trichloromethane
CHCl3 + Cl2 ![]() CCl4 + HCl
CCl4 + HCl
tetrachloromethane
Khi thực hiện phản ứng thế halogen vào các alkane có từ 3 nguyên tử carbon trở lên sẽ thu được hỗn hợp các sản phẩm thế monohalogen.
Ví dụ:
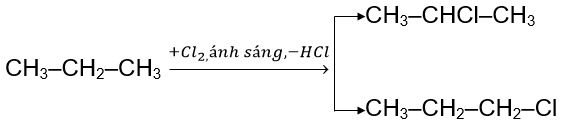
Phản ứng đặc trưng của alkane, nguyên tử H liên kết với nguyên tử C bậc cao dễ bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
2. Phản ứng cracking
Quá trình “bẻ gãy” các phân tử alkane mạch dài thành các phân tử hydrocarbon mạch ngắn hơn.
CnH2n+2 → CmH2m+2 + CpH2p
Ví dụ:
CH3-CH2-CH3 ![]() CH2=CH2 + CH4
CH2=CH2 + CH4
C12H26 ![]() C7H16 + C5H10
C7H16 + C5H10
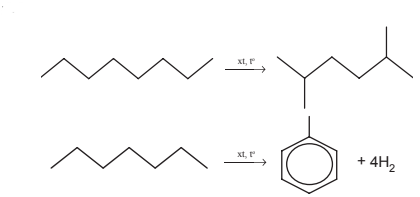
3. Phản ứng reforming
Reforming là quá trình biển đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng.
4. Phản ứng oxi hóa
4.1. Oxi hóa hoàn toàn
Các alkane thường dễ cháy và tỏa nhiều nhiệt.
![]()
CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
4.2. Oxi hóa không hoàn toàn
Trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C.
2C5H12 + 11O2 ![]() 10CO + 12H2O
10CO + 12H2O
V. Ứng dụng của alkane và điều chế alkane trong công nghiệp
Alkane được sử dụng làm nhiên liệu, dung môi, dầu nhờn,… và nguyên liệu để tổng hợp các chất hữu cơ khác nhau.
Trong công nghiệp, alkane được khai thác, chế biến từ khí thiên nhiên, khí đồng hành, dầu mỏ.
Ô nhiễm không khí do khói thải từ các phương tiện giao thông góp phần làm Trái Đất nóng lên và gây ra sự biến đổi khí hậu toàn cầu.
Tăng cường tham gia vận tải công cộng, giảm sự phụ thuộc nhiên liệu hóa thạch, bảo vệ rừng,… là những cách hạn chế sự ô nhiệm không khí.







