Đốt cháy hết 9,18 gam 2 đồng đẳng của benzene A, B thu được 8,1 gam H2O và V lít CO2 (đktc). Giá trị của V là:
Vì A và B chỉ tạo từ C và H nên:
mC = 9,18 – 0,9 = 8,28 gam
nCO2 = nC = 8,28/12 = 0,69 mol
VCO2 = 0,69.22,4 = 15,456 lít
Đốt cháy hết 9,18 gam 2 đồng đẳng của benzene A, B thu được 8,1 gam H2O và V lít CO2 (đktc). Giá trị của V là:
Vì A và B chỉ tạo từ C và H nên:
mC = 9,18 – 0,9 = 8,28 gam
nCO2 = nC = 8,28/12 = 0,69 mol
VCO2 = 0,69.22,4 = 15,456 lít
Toluene tác dụng với bromine theo tỷ lệ mol 1:1 (ánh sáng), thu được sản phẩm hữu cơ là
Phản ứng thế:
C6H5-CH3 + Br2 C6H5-CH2Br + HBr
Thể tích không khí (đktc) cần dùng để đốt cháy hoàn toàn 0,15 mol benzene là (biết trong không khí O2 chiếm 20% thể tích)
C6H6 + 15/2 O2 6CO2 + 3H2O
0,15 → 1,125
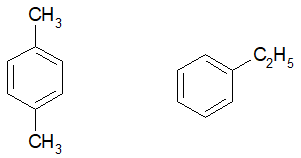
P-xylene có công thức cấu tạo là:




Số đồng phân hydrocarbon thơm ứng với công thức C8H10 là:
Độ bất bão hòa của C8H10 là:
Đây là hydrocarbon thơm nên có 1 vòng 6 cạnh chứa 3 liên kết đôi nên các đồng phân là:
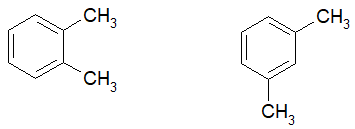
Benzene phản ứng chlorine khi có ánh sáng mặt trời thu được hexachlorocyclohexane. Công thức của hexachlorocyclohexane là:
Phương trình phản ứng:
C6H6 + 3Cl2 C6H6Cl6
hexachlorocyclohexane
Cho các hydrocarbon: ethene; acetylene; benzene; toluene; isopentane; styrene. Số chất làm mất màu dung dịch KMnO4 là:
Các chất làm mất màu dung dịch KMnO4 là 4 chất: ethene; acetylene; toluene; styrene.
Lưu ý: toluene làm mất màu dung dịch thuốc tím khi đun nóng.
Dãy đồng đẳng của benzene có công thức chung là:
Hydrocarbon thơm X có phần trăm khối lượng C xấp xỉ bằng 92,3%. Khi X tác dụng với bromine trong dung dịch tạo ra dẫn xuất dibromo Y trong đó phần trăm khối lượng bromine bằng 60,61%. Công thức cấu tạo của X là:
X tác dụng với bromine trong dung dịch tạo ra dẫn xuất dibromo nên X có nối đôi ngoài vòng thơm.
MX = 264 – 160 = 104
Số C trong X:
Công thức phân tử của X là C8H8
Công thức cấu tạo của X: C6H5-CH=CH2
Cho benzene tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzene. Khối lượng nitrobenzene điều chế được từ 27,3 tấn benzen (hiệu suất phản ứng 80%) là
C6H6 + HONO2 → C6H5NO2 + H2O
Khối lượng nitrobenzene điều chế được:
Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
- Styrene làm mất màu dung dịch KMnO4 và bị oxi hóa ở nhóm vinyl nên phản ứng xảy ra ngay nhiệt độ thường.
- Toluene làm mất màu dung dịch KMnO4 khi đun nóng.
- Benzene và methane không làm mất màu dung dịch KMnO4.
Lấy 97,5 gam benzene đem nitro hóa, thu được nitrobenzene (hiệu suất 80%). Đem lượng nitrobenzene thu được khử bằng hydrogen nguyên tử mới sinh bằng cách cho nitrobenzene tác dụng với bột sắt trong dung dịch HCl có dư (hiệu suất 100%), thu được chất hữu cơ X. Khối lượng chất X thu được là:
nX = 1,25.80% = 1 mol
mX = 1.129,5 = 129,5 gam
Kết luận nào sau đây là không đúng?
C6H5-CH=CH2 + Br2 → C6H5-CHBr-CH2Br
Hydrocarbon X là đồng đẳng của benzene có phần trăm khối lượng carbon bằng 90,56%. Biết khi X tác dụng với bromine có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu được một dẫn xuất monobromo duy nhất. Tên của X là
Gọi công thức phân tử của X là CnH2n-6 (n > 6)
Ta có:
n = 8 (C8H10)
Vì X tác dụng với brom có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu được một dẫn xuất monobromine duy nhất nên X có các nhánh đối xứng nhau, công thức cấu tạo của X là:

Tên của X là: 1,4-dimethylbenzene.
Khi trên vòng benzene có sẵn nhóm thế -X, thì nhóm thứ hai sẽ ưu tiên thế vào vị trí o- và p-. Vậy -X là những nhóm thế nào?
Quy tắc thế ở vòng benzene: Khi ở vòng benzene đã có sẵn nhóm alkyl (hay các nhóm –OH, –NH2, –OCH3,…), phản ứng thế vào vòng sẽ ưu tiên xảy ra ở vị trí ortho và para. Ngược lại, nếu ở vòng benzene đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, -SO3H,…) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
