Cân bằng trong dung dịch nước
I. Sự điện li, chất điện li, chất không điện li
1. Tìm hiểu hiện tượng điện li
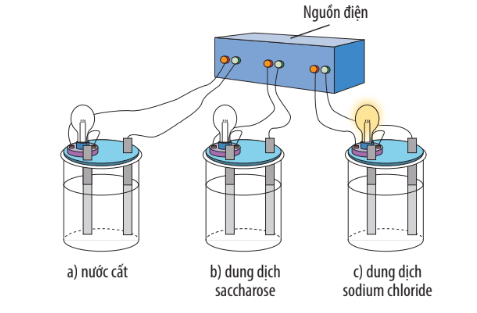 Mô phỏng thí nghiệm khảo sát tính dẫn điện của nước cất và một số dung dịch
Mô phỏng thí nghiệm khảo sát tính dẫn điện của nước cất và một số dung dịch
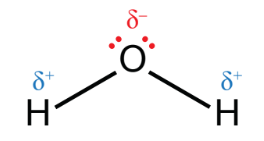 Cấu tạo phân tử của nước
Cấu tạo phân tử của nước
- H2O là phân tử có cực.
- Khi cho NaCl tinh thể vào nước, xảy ra quá trình tương tác giữa các phân tử nước có cực và các ion của muối, kết hợp với sự chuyển động hỗn loạn không ngừng của các phân tử nước làm cho các ion Na+ và Cl- của muối tách dần khỏi tinh thể và hòa tan vào nước, gọi là quá trình điện li hay sự điện li.
- NaCl được gọi là chất điện li, tan vào nước tạo ra ion và thu được dung dịch dẫn điện, gọi chung là chất điện li.
Phương trình điện li:
NaCl + (n + m)H2O ![]() Na+.nH2O + Cl-.mH2O
Na+.nH2O + Cl-.mH2O
hay
NaCl → Na+ + Cl-
Quá trình phân li các chất trong nước tạo thành các ion được gọi là sự điện li.
Ví dụ:
NaOH → Na+ + OH-
HCl → H+ + Cl-
2. Tìm hiểu sự phân loại các chất điện li
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion.
- Chất điện li mạnh bao gồm acid mạnh, base mạnh và hầu hết các muối tan.
- Phương trình điện li của chất điện li mạnh sử dụng mũi tên 1 chiều (→).
Ví dụ:
Chất điện li: HCl, HNO3, NaOH, KOH, KCl, Na2SO4, …
Phương trình điện li:
HCl → H+ + Cl-
NaOH → Na+ + OH-
Chất điện li yếu là chất khi tan trong nước, chỉ có một số phân tử hòa tan thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Chất điện li yếu bao gồm các acid yếu, base yếu.
- Phương trình điện li của chất điện li yếu sử dụng hai nửa mũi tên ngược chiều nhau (⇌).
Ví dụ:
Chất điện li: CH3COOH, HClO, H2S, Mg(OH)2, Fe(OH)3, …
Phương trình điện li:
CH3COOH ⇌ CH3COO- + H+
Chất không điện li là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
II. Thuyết Brønsted - Lowry về acid - base
1. Tìm hiểu thuyết Brønsted - Lowry về acid - base
Thuyết Brønsted - Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
Ví dụ:
- Trong dung dịch CH3COOH:
CH3COOH + H2O ⇌ CH3COO– + H3O+
CH3COOH là chất cho proton H+ nên đóng vai trò acid.
- Trong dung dịch NaHCO3:
HCO3– + H2O ⇌ H3O+ + CO32–
HCO3– + H2O ⇌ H2CO3 + OH–
Ion HCO3– trong nước vừa có thể cho proton (H+), vừa có thể nhận proton (H+) nên gọi là chất lưỡng tính.
III. Khái niệm pH chất chỉ thị Acid - base
1. Tìm hiểu khái niệm pH
Nước là chất điện li yếu:
H2O + H2O ⇌ H3O+ + OH– hay H2O ⇌ H+ + OH–
Tích số nồng độ các ion H+ và OH– trong nước nguyên chất hoặc trong dung dịch nước có nồng độ chất tan không quá cao ở mỗi nhiệt độ là một hằng số, gọi là tích số ion của nước, kí hiệu Kw:
Kw = [H+][OH–]
Ở 25oC, Kw = 10-14
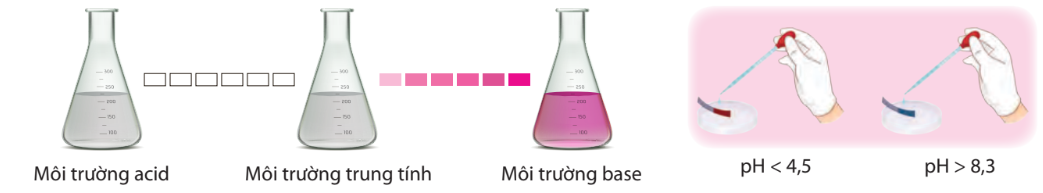
- Môi trường trung tính là môi trường trong đó: [H+] = [OH–] = 10-7 M
- Môi trường acid là môi trường trong đó: [H+] > [OH–] hay [H+] > 10-7 M.
- Môi trường kiềm là môi trường trong đó: [H+] < [OH–] hay [H+] < 10-7 M.
Độ acid và độ kiềm của dung dịch có thể được đánh giá bằng nồng độ H+ hoặc quy về một giá trị gọi là pH với quy ước như sau:
pH = –lg[H+]
Nếu [H+] = 10-a thì pH = a
Trong đó [H+] là nồng độ mol của ion H+ trong dung dịch.
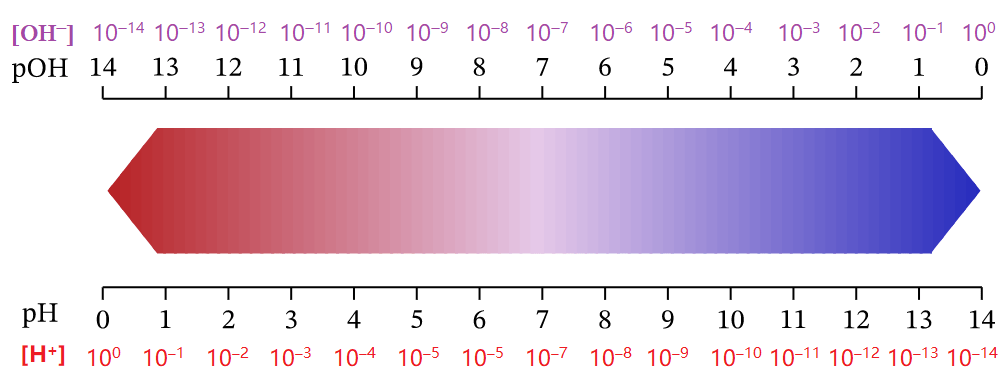
pH là chỉ số đánh giá độ acid hay base của một dung dịch.
Thang pH thường dùng có giá trị từ 1 đến 14.
2. Tìm hiểu ý nghĩa của pH trong thực tiễn
Độ pH là một trong những yếu tố rất quan trọng để đánh giá các tiêu chí liên quan đến môi trường cũng như sức khỏe của con người.
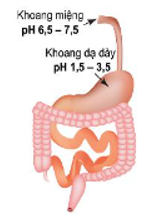
pH trong hệ tiêu hóa của con người
3. Tìm hiểu chất chỉ thị acid - base
- Sự thay đổi màu trong các môi trường đối với giấy pH (a), dung dịch phenolphthalein (b), giấy quỳ tím (c):
 |
|
| a) Giấy chỉ thị vạn năng | |
 |
|
| b) Dung dịch phenolphtalein | c) Quỳ tím |
- Người ta có thể dùng máy đo pH để xác định giá trị pH của một dung dịch.
 Máy đo pH để bàn
Máy đo pH để bàn
IV. Chuẩn độ Acid - Base
Nguyên tắc: Chuẩn độ acid - base là phương pháp được sử dụng để xác định nồng độ dung dịch acid hoặc dung dịch base bằng dung dịch base hoặc acid đã biết chính xác nồng độ (gọi là dung dịch chuẩn).
Trong phương pháp này người ta sử dụng dung dịch acid đã biết nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch base hoặc dùng dung dịch base đã biết nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch acid.
Khi chuẩn độ:
- Thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác.
- Thời điểm mà hai chất tác dụng vừa đủ với nhau gọi là điểm tương đương.
- Để nhận biết điểm tương đương, người ta thường dùng những chất chỉ thị acid - base gây ra sự đổi màu ở khoảng pH gần với điểm tương đương.
Thao tác chuẩn độ: Tay thuận cầm bình tam giác, lắc nhẹ dung dịch trong bình, tay không thuận điều khiển khóa burette để thêm từ từ từng giọt dung dịch trên burette vào bình tam giác.

Thao tác chuẩn độ
V. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32-
1. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
Phèn chua hay phèn nhôm - kali (k2SO4.Al2(SO4)3.24H2O), phèn sắt ((NH4)2SO4.Fe2(SO4)3.24.H2O) được sử dụng như là chất keo tụ trong quá trình xử lí nước (nước thải, nước giếng khoan,...) do tạo Al(OH)3, Fe(OH)3 dạng keo, kéo theo các chất bẩn lơ lửng trong nước lắng xuống.
M3+ + 3H2O ⇌ M(OH)3![]() + 3H+
+ 3H+
Kết luận: Ion Al3+, Fe3+, dễ bị phân hủy trong nước tạo thành base không tan và cho môi trường acid.
2. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
Soda (Na2CO3) được xem là hóa chất hiệu quả để làm tăng pH của hồ bơi khi pH hồ bơi quá thấp.
CO32- + H2O ⇌ HCO3- + OH-
Kết luận: Ion CO32- bị phân hủy cho môi trường base.







