Khi thực hiện phản ứng tách nước với alcohol X, chỉ thu được một alkene duy nhất. Oxi hóa hoàn toàn một lượng X thu được 5,6 lít CO2 và 5,4 gam nước. Hỏi có bao nhiêu công thức cấu tạo phù hợp với X?
nCO2 = 0,3 mol
nH2O = 0,25 mol
X tách nước tạo 1 alkene → X là ancol no, đơn chức và chỉ có 1 hướng tách
Gọi công thức phân tử của X là CnH2n+1OH:
nalcohol = nH2O – nCO2 = 0,3 - 0,25 = 0,05 mol
Công thức phân tử của X là C5H11OH.
Công thức cấu tạo của X thỏa mãn là:
CH3 – CH2 – CH2 – CH2 – CH2OH
CH3 – CH(CH3) – CH2 – CH2OH
CH3 – CH2 – CH(CH3) – CH2OH








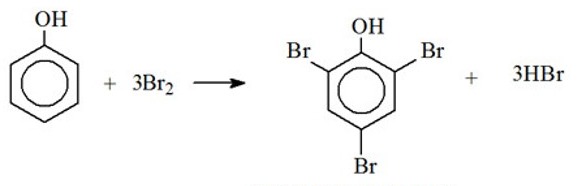
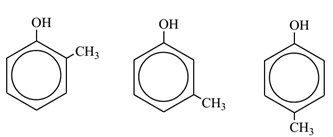 Vậy có 3 đồng phân phenol ứng với công thức phân tử C7H8O.
Vậy có 3 đồng phân phenol ứng với công thức phân tử C7H8O. 