Một số hợp chất với oxygen của nitrogen
I. Các oxide của nitrogen - hiện tượng mưa acid
1. Tìm hiểu nguồn gốc các oxide của nitrogen trong không khí
- Khí nitrogen monoxide (NO) được tạo thành trong không khí ở nhiệt độ cao.
N2(g) + O2(g) ![]() 2NO(g)
2NO(g)
- Ở điều kiện thường, khí NO không màu kết hợp với oxygen trong không khí tạo khí nitrogen dioxide (NO2) màu nâu đỏ.
2NO + O2 ![]() 2NO2
2NO2

Hiện tượng sấm sét
Nitrogen oxide được hình thành từ những hiện tượng tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao. Các khí này độc, gây ảnh hưởng nghiêm trọng đến sức khỏe con người. Chúng cũng là một trong những nguyên nhân chính gây nên hiện tượng hiệu ứng nhà kính và hiện tượng mưa acid.
2. Tìm hiểu về hiện tượng mưa acid
Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6.
- Quá trình hình thành: do sự oxi hóa SO2 và NOx với xúc tác của các ion kim loại trong khói, bụi,...Các khí này hòa tan trong nước tạo thành dung dịch H2SO4 và dung dịch HNO3.
Ví dụ:
2SO2 + O2 + 2H2O ![]() 2H2SO4
2H2SO4
4NO2 + O2 + 2H2O ![]() 4HNO3
4HNO3
- Nguyên nhân: Do hoạt động của núi lửa, cháy rừng, sấm sét, quá trình tiêu thụ nhiên liệu than đá, dầu mỏ,...
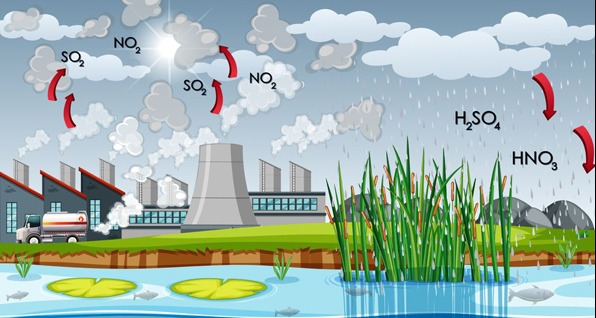 Quá trình hình thành mưa acid
Quá trình hình thành mưa acid
- Hậu quả: Hiện tượng mưa acid ảnh hưởng trực tiếp đến đời sống con người, động - thực vật, làm thay đổi thành phần của nước sông, hồ, gây hại cho động vật sống dưới nước, hủy hoại các công trình kiến trúc, ...
 |
 |
 |
| Một số tác hại của mưa acid | ||
II. Nitric acid
1. Tìm hiểu cấu tạo phân tử, tính chất vật lí của nitric acid
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 là liên kết cộng hóa trị và liên kết cho nhận.
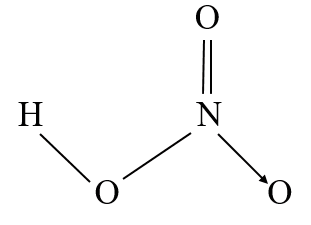 |
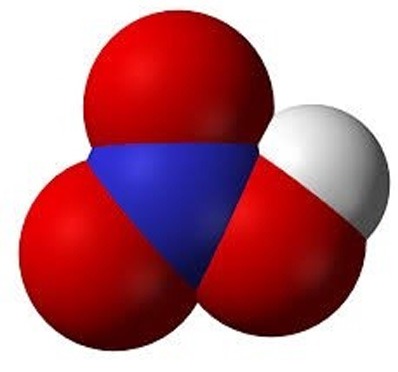 |
 |
| a) Cấu tạo phân tử nitric acid | b) Mô hình phân tử nitric acid | c) Nitric acid được bảo quản trong lọ thủy tinh tối màu |
- Nitric acid tinh khiết kém bền, bị phân hủy một phần ngay ở điều kiện thường khi có ánh sáng.
2HNO3 ![]() 2NO2 + O2 + H2O
2NO2 + O2 + H2O
- Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm3, sôi ở 86˚C.
- Nitric acid tan trong nước theo bất kỳ tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%.
2. Tìm hiểu tính chất hóa học và một số ứng dụng thực tiễn quan trọng của nitric acid
Tính chất hóa học của HNO3:
- Nitric acid là một acid mạnh, trong dung dịch loãng phân li hoàn toàn thành H+ và NO3-
HNO3 ![]() H+ + NO3-
H+ + NO3-
- Dung dịch HNO3 làm quỳ tím hóa đỏ, tác dụng với basic oxide, base và muối của acid yếu hơn tạo thành muối nitrate.
Ví dụ:
2HNO3 + CuO → Cu(NO3)2 + H2O2
HNO3 + NaOH → NaNO3 + H2O
2HNO3 + K2CO3 → KNO3 + H2O + CO2↑
Một số ứng dụng quan trọng của HNO3:
- Nitric acid là một trong ba acid chính của ngành công nghiệp hóa chất hiện đại và có khả năng ăn mòn kim loại.
- Nitric acid là một acid có tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại trừ vàng (Au), platium (Pt), …
Ví dụ:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Lưu ý: một số kim loại như Al, Fe, Cr, … bị thụ động hóa trong dung dịch HNO3 đặc, nguội do tạo ra màng oxide bền, bảo vệ kim loại khỏi tác dụng của acid.
- Nitric acid có nhiều ứng dụng quan trọng trong đời sống và sản xuất: sản xuất thuốc nổ trinitrotoluene (TNT), sản xuất nitrobenzene, nước cường toan, sản xuất phân bón,…
 |
 |
 |
| Sản xuất thuốc nổ | Sản xuất phân bón | Sản xuất thuốc nhuộm vải |
| Một số ứng dụng của HNO3 trong đời sống |
||
III. Hiện tượng phú dưỡng
Hiện tượng phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).


Hiện tượng phú dưỡng ở ao hồ
Nguyên nhân:
- Các chất dinh dưỡng do các vi sinh vật tạo ra không được tiêu thụ hết gây ra tình trạng dư thừa.
- Chất thải công nghiệp, chất thải sinh hoạt, ... không được xử lí theo quy chuẩn khi thải ra sông, hồ.
Hậu quả:
Ao hồ bị phú dưỡng làm các loài thực vật sống dưới nước phát triển mạnh mẽ, làm tăng chất lơ lửng, chất hữu cơ dẫn đến sự suy giảm lượng oxygen trong nước, nhất là tầng sâu làm ảnh hưởng đến chất lượng nước, ô nhiễm môi trường nước, ...







