Ứng dụng không phải của ammonia là
Đề kiểm tra 45 phút Hóa 11 Chương 2: Nitrogen và sulfur CTST
- Bài kiểm tra này bao gồm 40 câu
- Điểm số bài kiểm tra: 40 điểm
- Thời gian làm bài: 50 phút
- Xem lại kỹ lý thuyết trước khi làm bài
- Chuẩn bị giấy và bút để nháp trước khi bắt đầu
-
Câu 1:
Nhận biết
Ứng dụng không phải của ammonia
-
Câu 2:
Vận dụng cao
Tính số mol HNO3 phản ứng
Cho m gam Mg, Zn, Al, Cu tác dụng hết với HNO3 thu được 16,8 lít hỗn hợp khí Z: NO, NO2 ,N2, N2O (không tạo muối ammonium). Số mol NO và N2O bằng nhau. Tỉ khối của Z so với H2 là 18,5. Số mol HNO3 phản ứng
Hướng dẫn:NO và N2O có số mol bằng nhau. Ta quy đổi 2 khí này thành: NO2, N2
Hỗn hợp khí Z coi như gồm N2 (x mol), NO2 (y mol)
MZ = 18,5.2= 37
nZ = V:22,4 = 0,75 mol
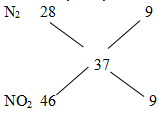
=> nN2 = nNO2 = 0,75:2 = 0,375 mol
Gọi công thức chung của hỗn hợp kim loại là M, hóa trị n
M0 → +ne
a na
2N+5 + 10e → N20
0,75 ← 3,75 ← 0,375
N+5 +1e → N+4
0,375 ← 0,375 ← 0,375
Bảo toàn e: na = 3,75 + 0,375= 4,125
=> na = 4,125
nHNO3 = n. nFe(NO3)n + nNO2 + 2nN2
= 4,125 + 0,375 + 2.0,375 = 5,25 mol.
-
Câu 3:
Nhận biết
Tính chất hóa học của nitric acid
Nitric acid là một acid có tính:
Hướng dẫn:Nitric acid là một acid mạnh và có tính oxi hóa mạnh.
-
Câu 4:
Thông hiểu
Tính chất hóa học của H2SO4
Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3, tổng số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là:
Hướng dẫn:Các chất thỏa mãn yêu cầu đề bài chất vừa tác dụng với dung dịch H2SO4 loãng vừa tác dụng với dung dịch H2SO4 đặc nóng: CuO, Mg, KOH, Na2CO3.
-
Câu 5:
Nhận biết
Nitric acid tinh khiết
Nitric acid tinh khiết
-
Câu 6:
Thông hiểu
Tính chất đặc biệt của dung dịch H2SO4 đặc, nóng so với H2SO4 loãng
Tính chất đặc biệt của dung dịch H2SO4 đặc, nóng là tác dụng được với các chất trong dãy nào sau đây mà dung dịch H2SO4 loãng không tác dụng?
Hướng dẫn:- Dung dịch H2SO4 loãng không tác dụng với Ag, S, FeSO4.
- Dung dịch H2SO4 đặc, nóng có tính oxi hóa rất mạnh có thể oxi hóa được các chất: Ag, S, FeSO4.
-
Câu 7:
Vận dụng
Tính thành phần phần trăm Mg đã phản ứng
Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
Hướng dẫn:nMg = 0,2 mol
n2 = 0,95 mol
N2 + Mg
Mg3N2
nH2 phản ứng = 1 - 0,95 = 0,05 mol
nMg = 3nH2 phản ứng = 0,15 mol
-
Câu 8:
Thông hiểu
Xác định số oxi hóa của nguyên tố N trong NH4NO3
Số oxi hóa của N trong NH4NO3 là
Hướng dẫn:Gọi số oxi hóa của N trong NH4+ là x và trong NO3- là y.
Ta có số oxi hóa của H là +1 và của O là -2
Trong NH4+: x + 4.(+1) = +1
x = -3
Trong NO3-: x + 3.(−2) = -1
x = +5
-
Câu 9:
Thông hiểu
Tách NH3 ra khỏi hỗn hợp
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp người ta đã
Hướng dẫn:Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã nén và làm lạnh hỗn hợp để hóa lỏng NH3.
-
Câu 10:
Nhận biết
Chất xúc tác trong phản ứng tổng hợp ammonia
Chất xúc tác trong phản ứng tổng hợp ammonia là
Hướng dẫn:Chất xúc tác trong phản ứng tổng hợp ammonia là Fe.
-
Câu 11:
Nhận biết
Tính chất hóa học của nitrogen
Nitrogen chủ yếu thể hiện tính
Hướng dẫn:Trong điều kiện thích hợp, nitrogen chủ yếu thể hiện tính oxi hóa, nitrogen thể hiện tính khử khi tác dụng với oxygen.
-
Câu 12:
Thông hiểu
Phản ứng tạo thành khí nitrogen
Khí nitrogen có thể được tạo thành bằng phản ứng hóa học nào sau đây?
Hướng dẫn:4NH3 + 5O2
4NO + 6H2O
NH4NO3
N2O + 2H2O
2AgNO3
2Ag + 2NO2 + O2
NH4NO2
N2 + 2H2O
-
Câu 13:
Vận dụng
Tính giá trị của V
Cho 2,3 gam Na vào 200 ml dung dịch (NH4)2SO4 1M. Đun nóng thu được V lít khí (đktc). Giá trị của V là
Hướng dẫn:Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
Khí thu được gồm H2 và NH3.
nNa = 0,1 mol; n(NH4)2SO4 = 0,2 mol
nNaOH = 0,1 mol < 0,2
nNH3 = 0,1 mol
VNH3 = 2,24 lít
V = 2,24 + 1,12 = 3,36 lít.
-
Câu 14:
Vận dụng cao
Tính thể tích khí NO2
Cho 17,6 gam hỗn hợp X gồm S, FeS, FeS2 tan hoàn toàn trong dung dịch HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 duy nhất và dung dịch Y. Cho Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa trong không khí đến khối lượng không đổi thu được 62,6 gam chất rắn. V có giá trị:
Hướng dẫn:Quy đổi hỗn hợp X gồm Fe và S với số mol lần lượt là a và b
=> mhh X = 56a + 32b = 17,6 (1)
Ta có hỗn hợp X {S, Fe, FeS2}
dung dịch Y {Fe(NO3)2; H2SO4}
{Fe(OH)3; BaSO4}
{Fe2O3 và BaSO4}
Chất rắn thu được sau phản ứng cuối cùng là Fe2O3 và BaSO4
Áp dụng bảo toàn khối lượng Fe:
nFe2O3 = 1/2.nFe = 0,5a mol
Bảo toàn nguyên tố S: nBaSO4 = nS = b mol
=> mchất rắn = 0,5.a.160 + 233b = 62,6 (2)
Giải hệ phương trình (1), (2) ta được:
a = 0,2 mol; b = 0,2 mol
Bảo toàn electron ta có:
3nFe +6.nS = 1.nNO2
→ nNO2 = 3.0,2 + 6.0,2 = 1,8 mol
VNO2 = 1,8.22,4 = 40,32 lít.
-
Câu 15:
Vận dụng
Xác định nguyên tố R
R có oxide cao nhất là R2O5, trong hợp chất của R với hydrogen có 17,64% khối lượng H. Nguyên tố R là
Hướng dẫn:R có oxit cao nhất là R2O5
hợp chất của R với hygdrogen có dạng RH3.
MR = 14
Vậy M là nitrogen (N)
-
Câu 16:
Thông hiểu
Phân biệt các mẫu phân bón hóa học sau
Để phân biệt các mẫu phân bón sau: (NH4)2SO4, NH4Cl và Ca(H2PO4)2 cần dùng thuốc thử là
Hướng dẫn:Để phân biệt các mẫu phân hóa học trên ta sử dụng dung dịch Ba(OH)2
Có mùi khai bay lên và kết tủa trắng xuất hiện thì mẫu đó là (NH4)2SO4
Ba(OH)2 + (NH4)2SO4 → H2O + 2NH3↑ + BaSO4↓
Chỉ có mùi khai bay lên thì mẫu đó là NH4Cl
Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3↑ + 2H2O
Có kết tủa trắng xuất hiện mẫu đó là Ca(H2PO4)2
Ca(H2PO4)2 + 3Ba(OH)2 → Ca(OH)2 + 4H2O + Ba3(PO4)2↓
-
Câu 17:
Nhận biết
Tìm nhận xét không đúng về muối ammonium
Nhận xét nào dưới đây không đúng về muối ammonium?
Hướng dẫn:NH4+ + H2O ⇄ NH3 + H3O+
Muối amoni thường có môi trường acid.
-
Câu 18:
Thông hiểu
Phản ứng S vừa là chất khử, vừa là chất oxi hóa
Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
Hướng dẫn:S vừa nhường electron, vừa nhận electron
S vừa là chất oxi hóa, vừa là chất khử.
-
Câu 19:
Thông hiểu
Dãy các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid là
Hướng dẫn:HNO3 chỉ thể hiện tính acid là không có phản ứng oxi hóa - khử
các chất đều đã đạt số oxi hóa tối đa.
-
Câu 20:
Nhận biết
Ảnh hưởng của hiện tượng phú dưỡng
Phát biểu nào sau đây không phải ảnh hưởng của hiện tượng phú dưỡng?
Hướng dẫn:Ao, hồ bị phú dưỡng làm các loại thực vật sống dưới nước (như rong, tảo, lục bình, bèo,...) phát triển mạnh mẽ; làm tăng các chất lơ lửng, chất hữu cơ, dẫn đến sự suy giảm lượng oxygen trong nước, nhất là ở tầng sâu, gây ảnh hưởng không tốt đến chất lượng nước, làm ô nhiễm môi trường nước,...
-
Câu 21:
Vận dụng
Tính thể tích hỗn hợp N2 và H2 cần lấy để điều chế NH3
Thể tích hỗn hợp N2 và H2 (đkc) cần lấy để điều chế 102 gam NH3 (H = 25%) là
Hướng dẫn:N2 + 3H2
2NH3
Ta có: nNH3 = 6 mol
Theo phương trình: nN2= ½. nNH3 = 3 mol,
nH2 = 3/2nNH3 = 9 mol
Do hiệu suất bằng 25% nên:
nhỗn hợp = 12 + 36 = 48 mol
Vhỗn hợp = 48.22,4 = 1075,2 lít
-
Câu 22:
Nhận biết
Nước cường toan
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích lần lượt là:
Hướng dẫn:Hỗn hợp nitric acid đặc và hydrochloric acid đặc có tỉ lệ thể tích 1 : 3 (cũng tương ứng với tỉ lệ mol 1 : 3), được gọi là dung dịch nước cường toan.
-
Câu 23:
Nhận biết
Kim loại phản ứng với sulfur ở điều kiện thường
Ở điều kiện thường, kim loại nào sau đây tác dụng với sulfur?
Hướng dẫn:Hg là kim loại duy nhất phản ứng với S ở nhiệt độ thường:
Hg + S → HgS
-
Câu 24:
Vận dụng
Tính thành phần phần trăm các khí trong hỗn hợp khí Y
Đun nóng hỗn hợp gồm 28 gam bột sắt và 3,2 gam sulfur đến khi phản ứng hoàn toàn thu được hỗn hợp X. Cho hỗn hợp X phản ứng hoàn toàn với dung dịch HCl thu được hỗn hợp khí Y và dung dịch Z. Thành phần phần trăm theo thể tích của hỗn hợp khí Y là
Hướng dẫn:nFe = 0,5 mol; nS = 0,1 mol
Phương trình phản ứng:
Fe + S → FeS
0,1 ← 0,1 → 0,1
hỗn hợp X gồm: Fe (0,4 mol) và FeS (0,1 mol)
Fe + 2HCl → FeCl2 + H2
0,4 → 0,4
FeS + 2HCl → FeCl2 + H2S
0,1 → 0,1
hỗn hợp X gồm: H2 (0,4 mol) và H2S (0,1 mol)
Thành phần % về thể tích cũng chính là % theo số mol:
-
Câu 25:
Thông hiểu
Phân biệt các dung dịch
Có 4 dung dịch đựng trong 4 lọ mất nhãn: HCl, Na2SO4, NaCl, Ba(OH)2, chỉ dùng một thuốc thử có thể nhận biết được được tất cả các chất trên là:
Hướng dẫn:Khi cho quỳ tím lần lượt vào các chất :
HCl: cho màu đỏ (acid)
Ba(OH)2: cho màu xanh (base)
Na2SO4, NaCl: không đổi màu (muối)
Dùng Ba(OH)2 đã nhận biết ở trên để nhận ra Na2SO4 có kết tủa trắng BaSO4.
-
Câu 26:
Nhận biết
Thử màu dung dịch NH3 bằng quỳ tím
Cho quỳ tím vào dung dịch NH3 1M, quỳ tím
Hướng dẫn:Vì dung dịch NH3 có tính base
làm quỳ chuyển xanh.
-
Câu 27:
Nhận biết
Tìm phát biểu không đúng khi nói về sulfur dioxide
Phát biểu không đúng khi nói về sulfur dioxide là
Hướng dẫn:Sulfur dioxide (SO2) là chất khí không màu, mùi xốc, độc (hít phải sẽ viêm đường hô hấp), nặng hơn không khí hai lần, hóa lỏng ở -10oC, tan nhiều trong nước.
-
Câu 28:
Nhận biết
Ứng dụng chính của sulfur
Ứng dụng nào sau đây là ứng dụng chính của sulfur?
Hướng dẫn:Sulfur là nguyên liệu quan trọng cho nhiều ngành công nghiệp; khoảng 90% lượng sulfrur sản xuất được dùng để điều chế H2SO4; còn lại được dùng để lưu hóa cao su; chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
-
Câu 29:
Vận dụng cao
Tính thể tích dung dịch Pb(NO3)2
Nung hỗn hợp gồm 11,2 gam Fe; 6,4 gam Cu và 19,5 gam Zn với một lượng dư sulfur đến khi phản ứng hoàn toàn. Sản phẩm của phản ứng tác dụng với dung dịch HCl dư thu được khí B. Thể tích dung dịch Pb(NO3)2 20% (d = 1,1 g/ml) tối thiểu cần dùng để hấp thụ hết khí B là:
Hướng dẫn:nFe = 0,2 mol; nCu = 0,1 mol; n Zn = 0,3 mol
Fe, Cu, Zn tác dụng với S tạo các hợp chất FeS, CuS, ZnS nhưng chỉ có FeS và ZnS bị hòa tan bởi HCl.
nH2S = nFeS + nZnS = nFe + nZn = 0,2 + 0,3 = 0,5 mol
Phương trình hóa học
H2S + Pb(NO3)2 → PbS + 2HNO3
0,5 → 0,5 mol
→ nCu(NO3)2 = nH2S = 0,5 mol
-
Câu 30:
Vận dụng
Tính hiệu suất tổng hợp NH3
Cho vào bình kín 0,2 mol N2 và 0,8 mol H2 với xúc tác thích hợp. Sau một thời gian thấy tạo ra 0,3 mol NH3. Hiệu suất phản ứng được tổng hợp là:
Hướng dẫn:N2 + H2
NH3
Bđ: 0,2 0,8 0
Pư: 0,15
0,45
0,3
Spu: 0,05 0,35 0,3
Ta thấy:
Hiệu suất tính theo N2
-
Câu 31:
Vận dụng cao
Tính thể tích khí thu được
Tiến hành đốt cháy hoàn toàn 6,48 gam hỗn hợp X gồm: FeS, FeS2, S, Cu, CuS, FeCu2S2 thì cần 2,52 lít oxygen và thấy thoát ra 1,568 lít (đktc) SO2. Mặt khác cho 6,48 gam X tác dụng dung dịch HNO3 nóng dư thu được V lít khí màu nâu duy nhất (đktc, sản phẩm khử duy nhất) và dung dịch Y. Giá trị của V là:
Hướng dẫn:Quy đổi hỗn hợp X gồm Fe (x mol), Cu (y mol) và S (z mol)
Theo đầu bài ta có
mhỗn hợp = 56x + 64y + 32z = 6,48 (1)
Đốt cháy hỗn hợp X
nO2 = 2,52 : 22,4 = 0,1125 mol
Áp dụng bảo toàn electron ta có:
3.nFe + 2.nCu + 4.nSO2 = 4.nO2
=> 3x + 2y + 4z = 4.0,1125 (2)
Bảo toàn nguyên tố S:
nS = nSO2 => z = 0,07 mol (3)
Giải hệ phương trình (1), (2), (3) ta có:
=> x = 0,03; y = 0,04
Cho X vào dung dịch HNO3 dư thu được khí NO2
Áp dụng bảo toàn electron:
nNO2 = 3.nFe + 2.nCu + 6.nS
=> nNO2= 3.0,03 + 2.0,04 + 6.0,07 = 0,59 mol
=> VNO2 = 0,59.22,4 = 13,216 lít.
-
Câu 32:
Vận dụng
Tính giá trị của V
Nhúng thanh sắt dư vào 200 ml dung dịch chứa HCl 0,2M và mol H2SO4 0,1M đến khi phản ứng hoàn toàn thu được V lít khí. Giá trị của V là
Hướng dẫn:nHCl = 0,2.0,2 = 0,4 mol; nH2SO4 = 0,2.0,1 = 0,02 mol
Fe + 2HCl → FeCl2 + H2
0,02 ← 0,04 → 0,02
Fe + H2SO4 → FeSO4 + H2
0,02 ← 0,02 → 0,02
nH2 = 0,02 + 0,02 = 0,04 mol
VH2 = 0,04.22,4 = 0,896 lít
-
Câu 33:
Nhận biết
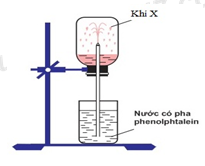
Thử tính chất của khí X
Trong phòng thí nghiệm, để thử tính chất của khí X người ta đã thực hiện thí nghiệm như hình vẽ dưới đây

Khí X là
Hướng dẫn:Khí X làm đổi màu dung dịch phenolphtalein sang màu hồng
khí X tan trong nước, tạo thành dung dịch có tính base
X là NH3.
-
Câu 34:
Thông hiểu
Dãy gồm các chất đều tác dụng với sulfur
Dãy gồm các chất đều tác dụng với sulfur (trong điều kiện phản ứng thích hợp) là:
Hướng dẫn:S không tác dụng với Pt; HCl; He, H2SO4 loãng.
S tác dụng với dãy chất: Zn, H2, O2, F2.
S + Zn
ZnS
S + H2
H2S
S + O2
SO2
S + 3F2
SF6
-
Câu 35:
Vận dụng
Tính khối lượng acid H2SO4 98% thu được
Dùng 300 tấn quặng ion pyrite (FeS2) có lẫn 20% tạp chất để sản xuất acid H2SO4 có nồng độ 98%. Biết rằng hiệu suất phản ứng là 90%. Khối lượng acid H2SO4 98% thu được là
Hướng dẫn:Ta có sơ đồ : FeS2
2SO2
2SO3
2H2SO4
Theo lý thuyết thì:
Thực tế thì:
-
Câu 36:
Thông hiểu
Xác định thành phần của Y
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
Hướng dẫn:NH3 dư có Cu(OH)2 và Zn(OH)2 tạo phức tan
Kết tủa thu được gồm Fe(OH)3, Al(OH)3, Mg(OH)2.
-
Câu 37:
Vận dụng
Tính hiệu suất của phản ứng nhiệt phân muối amonium nitrate
Người ta điều chế khí N2 từ phản ứng nhiệt phân muối ammonium nitrate theo phương trình NH4NO2 → N2+ 2H2O. Biết khi nhiệt phân 32 gam muối thu được 10 gam chất rắn. Hiệu suất của phản ứng này là
Hướng dẫn:NH4NO2 → N2 + 2H2O
x x 2x mol
mchất rắn giảm = mN2 + mH2O = 28x + 2.18x = 32 - 10 = 22
x = 0,34375 mol
-
Câu 38:
Nhận biết
Khí chiếm tỉ lệ thể tích lớn nhất trong không khí
Khí chiểm tỉ lệ thể tích lớn nhất trong không khí là
Hướng dẫn:Nitrogen chiếm khoảng 78% thể tích của không khí, là khí chiểm tỉ lệ thể tích lớn nhất trong không khí là N2.
-
Câu 39:
Vận dụng
Tính khối lượng Cu(NO3)2 trong hỗn hợp
Nhiệt phân hoàn toàn 52,8 gam hỗn hợp Cu(NO3)2; AgNO3 thu được chất rắn X. Hòa tan X trong dung dịch HNO3 dư thấy thoát ra 4,48 lít khí NO2 (đktc). Khối lượng Cu(NO3)2 trong hỗn hợp là
Hướng dẫn:Ta có sơ đồ phản ứng:
Khi cho X phản ứng với HNO3 dư thì chỉ có phản ứng oxi hóa - khử giữa Ag và HNO3, quá trình nhường - nhận electron:
x ← x 0,2 ← 0,2
nAg = x = 0,2 mol
- Bảo toàn Ag
nAgNO3 = nAg = 0,2 mol
mAgNO3 = 0,2.170 = 34 gam
mCu(NO3)2 = mhh – mAgNO3 = 52,8 - 34 = 18,8 gam.
-
Câu 40:
Vận dụng
Tinh thể tích N2 cần dùng để điều chế NH3
Để điều chế 2 lít NH3 từ N2 và H2 với hiệu suất 25% thì thể tích N2 cần dùng ở cùng điều kiện là
Hướng dẫn:N2 + H2
NH3
Theo phương trình hóa học:
VN2 = 0,5.VNH3 = 0,5.2 = 1 lít
Do hiệu suất đạt 25% nên lượng N2 cần dùng là: VN2 cần dùng = 1/25% = 4 lít
Chúc mừng Bạn đã hoàn thành bài!
-
Nhận biết (35%):
2/3
-
Thông hiểu (28%):
2/3
-
Vận dụng (28%):
2/3
-
Vận dụng cao (10%):
2/3
- Thời gian làm bài: 00:00:00
- Số câu làm đúng: 0
- Số câu làm sai: 0
- Điểm số: 0
-
Đề thi Hóa học 11 CTST
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen và sulfur
-
Chương 3: Đại cương hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl (Aldehyde - Ketone) - Carboxylic acid