Nguyên tố nitrogen (Z = 7) thuộc:
Nguyên tố nitrogen (Z = 7)
⇒ Cấu hình electron của nitrogen (N) là: 1s22s22p3.
⇒ N có 5 electron lớp ngoài cùng
⇒ Nguyên tố nitrogen (N) ở ô số 7, chu kì 2, nhóm VA
Nguyên tố nitrogen (Z = 7) thuộc:
Nguyên tố nitrogen (Z = 7)
⇒ Cấu hình electron của nitrogen (N) là: 1s22s22p3.
⇒ N có 5 electron lớp ngoài cùng
⇒ Nguyên tố nitrogen (N) ở ô số 7, chu kì 2, nhóm VA
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion.
Các chất điện li mạnh thường gặp là:
Các acid mạnh: HCl, HNO3, ...
Các base mạnh: NaOH, KOH, Ca(OH)2,...
Hầu hết các muối
⇒ Dãy gồm các chất điện li mạnh là: H2SO4, ZnCl2, Al2(SO4)3, Ca(OH)2.
Trong bình định mức 2,00 lít ban đầu chỉ chứa 0,777 mol SO3 (k) tại 1100 K. Tính giá trị KC của phản ứng dưới đây, biết tại trạng thái cân bằng có 0,52 mol SO3: 2SO3(g) ⇄ 2SO2(g) + O2(g)
nSO2 phản ứng = 0,777 – 0,52 = 0,257 (mol)
2SO3(g) ⇄ 2SO2(g) + O2(g)
Bđ: 0,777
P/ư: 0,257 → 0,1285 → 0,257
Cb: 0,52 0,1285 0,257
Hằng số cân bằng:
Dung dịch muối nào sau đây có pH > 7?
Muối tạo bởi base mạnh và acid mạnh ⇒ Môi trường trung tính (pH = 7)
Muối tạo bởi base mạnh và acid yếu ⇒ môi trường base (pH > 7)
Muối tạo bởi base yếu và acid mạnh ⇒ Môi trường acid (pH < 7)
Dung dịch muối có pH > 7 là Na2CO3 được tạo bởi base mạnh NaOH và acid yếu H2CO3
Cho các chất sau: K3PO4, H2SO4, HClO, HNO2, NH4Cl, HgCl2, Sn(OH)2. Các chất điện li yếu là:
Chất điện lí yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
Những chất điện li yếu gồm các acid yếu như CH3COOH, HClO, HF, ... và các base yếu như Cu(OH)2, Fe(OH)3,...
⇒ Các chất điện li yếu là: HClO, HNO2, CH3COOH, Sn(OH)2.
Điều nào dưới đây không phải là tác hại do mưa acid gây ra?
Bão sấm sét không phải do mưa acid gây ra.
Hiện tượng phú dưỡng có thể gây ra
Hiện tượng phú dưỡng có thể gây ra ô nhiễm môi trường nước.
Phản ứng nào sau đây là phản ứng thuận nghịch?
Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau là chiều thuận và chiều nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều ⇌.
Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 12,395 lít (đkc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
Khí thu được là NH3, phương trình ion rút gọn của phản ứng:
NH4+ + OH− → NH3 + H2O
Theo phương trình hóa học:
nOH- = nNH3 = = 0,5 mol
CM = n/V = 0,5/0,1 = 5 M
Ta thường thấy nitric acid được bảo quản trong các lọ tối màu là vì
Nitric acid tinh khiết kém bền, bị phân hủy một phần giải phóng nitrogen dioxide (NO2) ngay ở điều kiện thường khi có ánh sáng. Do đó nitric acid được bảo quản trong các lọ tối màu.
Quan sát hình vẽ thí nghiệm dưới đây và cho các nhận xét sau:

(1) Thí nghiệm trên chứng tỏ NH3 tan nhiều trong nước.
(2) Thí nghiệm trên cho thấy NH3 có tính base.
(3) Nước phun vào bình do NH3 tan mạnh trong nước làm tăng áp suất trong bình.
(4) Nước trong bình chuyển từ hồng sang xanh.
Số nhận xét đúng là:
Số nhận định đúng là 2:
(1) Thí nghiệm trên chứng tỏ NH3 tan nhiều trong nước.
(2) Thí nghiệm trên cho thấy NH3 có tính base.
Acid nào sau đây phân li hoàn toàn trong nước.
Acid mạnh phân li hoàn toàn trong nước (H2SO4).
Xét phản ứng trong quá trình tạo ra NOx nhiệt:
N2(g) + O2(g) → 2NO(g) ![]() = 180,6 kJ
= 180,6 kJ
Nhiệt tạo thành chuẩn của NO(g) là
Phản ứng trên tổng hợp khí NO(g) từ dạng đơn chất bền nhất của nguyên tố N và O, nhưng sau phản ứng lại tổng hợp được 2 mol NO(g). Vậy nên, nhiệt tạo thành chuẩn của NO(g) phải bằng 1 nửa của nhiệt phản ứng: N2(g) + O2(g) → 2NO(g).
Khi tăng áp suất không ảnh hưởng tới cân bằng của phản ứng nào sau đây?
Áp suất không ảnh hưởng đến cân bằng hóa học có tổng hệ số chất khí hai vế bằng nhau nên phản ứng
H2 + Cl2 ⇄ 2HCl.
Phương trình mô tả sự điện li của Na2CO3 trong nước là
Chất tan trong dung dịch khi phân li sẽ thành các ion.
Phương trình điện li của Na2CO3 trong nước là
Na2CO3(s) 2Na+(aq) + CO32−(aq).
Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
![]()
Số phản ứng thuộc loại oxi hoá - khử trong sơ đồ là
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa chất phản ứng hay phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
Các phản ứng thuộc loại phản ứng oxi hóa khử là: (1), (2), (3)
Nguyên tố nitrogen có số oxi hóa trong các hợp chất: NH3, NH4Cl lần lượt là:
Nguyên tố nitrogen có số oxi hóa trong các hợp chất: NH3, NH4Cl lần lượt là: -3 và -3
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) ... vào dung dịch đựng trong bình tam giác. Dụng cụ cần điền vào (1) là
Người ta thêm từ từ chất trong burette vào dung dịch đựng trong bình tam giác khi tiến hành chuẩn độ.
Cho 15 ml dung dịch HNO3 có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)2 có pH = a. Giá trị của a là:
nHNO3 = 1,5.10-2.10-2 = 1,5.10-4 ⇒ nBa(OH)2 = 7,5.10-5 mol
⇒ CM(OH–) = 1,5.10-4/10-2 = 1,5.10-2 ⇒ pOH = 1,8 ⇒ pH = 12,2
Tiến hành thí nghiệm cho cây nến đang cháy ở ngoài không khí vào trong bình chứa khí nitrogen. Nhận xét nào sau đây đúng về thí nghiệm trên?
Khi cho cây nến đang cháy ở ngoài không khí vào trong bình chứa khí nitrogen cây nến không cháy trong khí nitrogen do nitrogen không duy trì sự cháy.
Trong tự nhiên, nitrogen không có trong hợp chất nào sau đây?
Trong tự nhiên, nitrogen không có trong hợp chất muối ăn.
Để trung hòa 20 mL dung dịch HCl 0,1 M cần 10 mL dung dịch NaOH nồng độ x mol/L. Giá trị của x là
nHCl = 0,1.0,02 = 0,002 (mol)
NaOH + HCl → NaCl + H2O
0,002 ← 0,002 (mol)
Phương trình mô tả sự điện li của KCl trong nước là:
Phương trình mô tả sự điện li của KCl trong nước là:
KCl(s) K+(aq) + Cl-(aq).
Khi hoà tan một dung dịch acid vào nước ở 25oC thu được kết quả là:
Khi hoà tan một dung dịch acid vào nước ở 25oC thu được dung dịch có môi trường acid
⇒ [H+] > [OH–].
Kim loại nào không phản ứng được với acid nitric acid?
Kim loại nào không phản ứng được với acid nitric acid là Au.
Chuẩn độ 25,0 ml một mẫu dung dịch NaOH phải dùng 27,88 ml dung dịch H2SO4 0,159 M. Nồng độ mol của dung dịch NaOH là bao nhiêu ?
nH2SO4 = 0,02788.0,159 = 4,433.10-3 mol
Phương trình phản ứng chuẩn độ:
2NaOH + H2SO4 Na2SO4 + H2O
mol: 4,433.10-3 ← 4,433.10-3
Chất nào sau đây thuộc loại chất điện li mạnh?
C2H5OH là chất không điện li.
H2S là chất điện li yếu.
KCl là chất điện li mạnh.
H2O là chất điện li yếu.
Cho phương trình: S2- + H2O ⇌ HS- + OH-. Phát biểu nào sau đây đúng?
S2- có khả năng nhận proton (H+) nên là base.
Trong công nghiệp, hydrogen được sản xuất từ phản ứng sau:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g).
Biết ở nhiệt độ 760oC, tất cả các chất đều ở thể khí và nồng độ các chất ở trạng thái cân bằng là: [CH4] = 0,126 mol/L; [H2O] = 0,242 mol/L; [H2] = 1,15 mol/L; [CO] = 0,126 mol/L M. Hằng số cân bằng KC của phản ứng trên tại 760oC là
Hằng số cân bằng KC của phản ứng ở 760oC là:
Công thức lewis của NH3 là
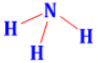
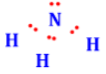
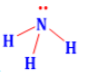
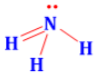
Công thức lewis của NH3 là

Cho dung dịch NH4NO3 tác dụng với dung dịch base của kim loại thu được 4,958 lít khí (đkc) và 26,1 gam muối. Kim loại đó là
Khí thu được sau phản ứng là NH3.
nNH3 = 0,2 mol
nNH4NO3 + M(OH)n M(NO3)n + nNH3 +nH2O
0,2/n ← 0,2
M = 68,5n
n = 2 và M là barium (Ba).
Thuộc tính nào sau đây không phải của khí nitrogen?
(1) Hóa lỏng ở nhiệt độ rất thấp (-196oC).
(2) Cấu tạo phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba.
(3) Tan nhiều trong nước
(4) Nặng hơn oxygen.
(5) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
Tính chất không thuộc khí nitrogen là:
(3) Tan nhiều trong nước
Khí nitrogen tan rất ít trong nước.
(4) Nặng hơn oxygen.
Khí nitrogen nhẹ hơn oxygen
(5) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
Saccharose là chất không điện li vì
Saccharose tan trong nước nhưng trong nước lại không phân li ra ion nên dung dịch saccharose không dẫn được điện.
Dung dịch nào sau đây có [H+] = 0,1 M?
Dung dịch KOH và Ca(OH)2 không phân li ra H+.
HF là acid yếu nên phân li không hoàn toàn [H+] < 0,1 M, còn HCl là acid mạnh, phân li hoàn toàn
[H+] = 0,1 M.
Chất nào sau đây được sử dụng là chất làm lạnh trong các hệ thống làm lạnh trong công nghiệp.
NH3 được sử dụng là chất làm lạnh trong các hệ thống làm lạnh trong công nghiệp
Dung dịch nào sau đây có nồng độ ion H+ cao nhất
pH càng nhỏ thì nồng độ H+ càng cao.
Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14N (99,63%) và 15N (0,37%). Nguyên tử khối trung bình của nitrogen là
Áp dụng công thức tính nguyên tử khối trung bình:
= 99,63%.14 + 0,37%.15 = 14,0037 ≈ 14,004.
Xét cân bằng hóa học:
NH3 + H2O ![]() NH4+ + OH-.
NH4+ + OH-.
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sao đây?
Khi thêm vài giọt dung dịch NH4Cl làm tăng nồng độ ion NH4+, cân bằng chuyển dịch theo chiều nghịch.
Khi thêm vài giọt KOH làm tăng nồng độ ion OH−, cân bằng chuyển dịch theo chiều nghịch.
Khi thêm vài giọt HCl làm tăng nồng độ ion H+, NH3 sẽ tác dụng với H+ để tạo ra NH4+, cân bằng chuyển dịch theo chiều thuận.
Khi thêm vài giọt KCl thì cân bằng không làm ảnh hưởng tới sự chuyển dịch của cân bằng hoá học.
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch HCl.
Phát biểu không đúng là
Nhận xét sai: Giá trị pH tăng thì độ acid tăng.
Vì giá trị pH tăng thì độ acid giảm.
Hòa tan hết m gam hỗn hợp X gồm Na, K, Ba, Na2O, K2O, BaO (trong X , oxygen chiếm 7,5% về khối lượng) và nước, thu được 200 ml dung dịch Y và 0,896 lít H2 (đktc). Cho hết Y vào 200 ml dung dịch HCl 0,5M; thu được 400 ml dung dịch Z có pH = 13. Giá trị của m là
Vì pH = 13 nên OH- dư
→ nOH− ban đầu = 0,4.0,1 + 0,2.0,5 = 0,14 mol
có nOH− = nNa + nK + 2nBa
Áp dụng bảo toàn electron
nNa + nK + 2nBa= 2nO + 0,04.2 → nO = 0,03 mol
Theo đề bài ta có: %mO = 16.nO : m = 0,075
→ m = 6,4 gam.
