Trong phân tử oxygen, số oxi hóa của nguyên tử oxygen là
Phân tử O2 là đơn chất số oxi hóa của nguyên tử oxygen là 0.
Trong phân tử oxygen, số oxi hóa của nguyên tử oxygen là
Phân tử O2 là đơn chất số oxi hóa của nguyên tử oxygen là 0.
Cho những nguyên tử của các nguyên tố sau:
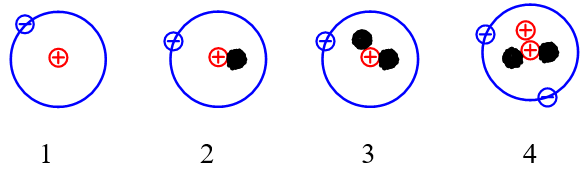
Những nguyên tử nào sau đây là đồng vị của nhau?
Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron dẫn đến số khối của chúng khác nhau.
Vậy các nguyên tử (1), (2), (3) là đồng vị của nhau do có số proton là 1.
Cho các nguyên tố Li, Na, K, Rb, Cs thuộc nhóm IA trong bảng tuần hoàn. Trong số các nguyên tố trên, nguyên tố có năng lượng ion hóa thứ nhất nhỏ nhất là
Trong một nhóm A, năng lượng ion hóa có xu hướng giảm theo chiều tăng dần của điện tích hạt nhân.
Một hợp chất ion có công thức X2Y. Hai nguyên tố X, Y thuộc hai chu kì kế cận nhau trong bảng tuần hoàn. X thuộc nhóm IA hoặc IIA. Y thuộc VIA hoặc VIIA. Biết tổng số electron trong X2Y là 30. X2Y là
Giả sử X thuộc nhóm IA thì X có dạng ion là X+.
Muốn tạo thành hợp chất X2Y thì X+ phải kết hợp với Y2- tức Y thuộc nhóm VIA
Có tổng số electron trong X2Y là 30 ⇒ 2.pX + pY = 30 (Thấy pX = 11; pY = 8)
⇒ X là Na; Y là O.
Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình thu gọn ở trạng thái cơ bản là [Ar]3d74s2. Số thứ tự cobalt trong bảng tuần hoàn là
Cấu hình nguyên tử của cobalt là: 1s22s22p63s23p64s23d74s2
Số thứ tự cobalt trong bảng tuần hoàn là 29.
Chẻ củi nhỏ khi đốt để nhanh cháy hơn là vận dụng yếu tố làm tăng tốc độ phản ứng nào sau đây?
Chẻ củi nhỏ khi đốt để nhanh cháy hơn là vận dụng yếu tố diện tích bề mặt để làm tăng tốc độ phản ứng.
Phản ứng hóa học nào sau đây chứng tỏ S là một chất oxi hóa?
Sulfur đóng vai trò chất oxi hóa trong phản ứng vì có số oxi hóa giảm từ 0 xuống -2.
Tổng số hạt p, n, e, của nguyên tử X là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu hóa học và vị trí của X (chu kỳ, nhóm) là
Đặt số p = số e = Z; số n = N
Tổng số hạt p, n, e, của nguyên tử X là 34:
2Z + N = 34 (1)
Số hạt mạng điện nhiều hơn số hạt không mang điện là 10:
2Z – N = 10 (2)
Từ (1) và (2) ta được: Z = 11 và N = 12
X là Na
Cấu hình e của nguyên tử Na là: 1s22s22p63s1
Vậy:
- Kí hiệu hóa học của X là Na.
- Vị trí của X trong bảng tuần hoàn:
Số đơn vị điện tích hạt nhân của nguyên tử magnesium là 12. Trong nguyên tử magnesium, số electron ở mức năng lượng cao nhất là:
12Mg: 1s22s22p63s2
Vậy trong nguyên tử magnesium, số electron ở mức năng lượng cao nhất là 2, nằm trong phân lớp 3s2.
Dung dịch muối nào sau đây tác dụng với dung dịch AgNO3 tạo kết tủa màu vàng nhạt?
NaF + AgNO3 không phản ứng
NaCl + AgNO3 AgCl + NaNO3
( trắng)
NaBr + AgNO3 AgBr + NaNO3
( vàng nhạt)
NaI+ AgNO3 AgI + NaNO3
( vàng)
Cấu hình electron nào sau đây là của nguyên tố thuộc nhóm VIIA?
Cấu hình electron của nguyên tố thuộc nhóm VIIA là 1s22s22p5.
Oxide của A có công thức hóa học AxOy là hợp chất khí, trong đó oxygen chiếm 69,57% về khối lượng. Biết rằng 7,437 lít khí này ở đktc có khối lượng là 13,8 gam. Cho các phát biểu sau:
(1) Nguyên tố A thuộc chu kì 2 của bảng tuần hoàn.
(2) A là phi kim.
(3) A có độ âm điện lớn hơn oxygen.
(4) Bán kính nguyên tử của A nhỏ hơn P.
(5) Hợp chất AxOy ở trên là oxide ứng với hóa trị cao nhất của A.
Trong các phát biểu trên, số phát biểu đúng là
Theo bài ra ta có:
A.x = 7y (1)
Từ (1) và (2) y = 2
A.x = 14
Với x = 1 thỏa mãn A = 14 (N)
Hợp AxOY là NO2
Vậy các phát biểu (1), (2), (4) đúng.
Chất nào sau đây không thể tạo được liên kết hydrogen?
- Phân tử CH3OH, H2O và NH3 có thể tạo liên kết hydrogen vì có nguyên tử H liên kết với nguyên tử có độ âm điện cao là O, N làm cho H linh động. Bên cạnh đó nguyên tử N, O đều có cặp electron chưa tham gia liên kết và có liên kết với nguyên tử hydrogen.
- CH4 không tạo được liên kết hydrogen với nhau vì C không có cặp electron hóa trị chưa tham gia liên kết.
Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12. Số khối của nguyên tử X.
Nguyên tử trung hòa về điện nên p = e.
Theo bài ra ta có:
p + e + n = 40 hay 2p + n = 40 (1)
Lại có: 2p – n = 12 (2)
Giải hệ hai phương trình (1) và (2):
⇒ p = e = 13 và n = 14
⇒ A = 13 + 14 = 27
Cho bảng thông tin về các hydrogen halide như sau:
| Hydrogen halide | (a) | (b) | (c) | (d) |
|
Năng lượng liên kết (kJ/mol) |
432 |
366 | 569 | 299 |
Chất (b) và (d) lần lượt là:
Năng lượng liên kết của hydrogen halide giảm dần từ HF đến HI
(c) là HF, (a) là HCl, (b) là HBr và (d) là HI
Trong nguyên tử, hạt không mang điện là:
Trong nguyên tử: hạt electron mang điện tích âm, hạt proton mang điện tích dương, hạt neutron không mang điện.
Phát biểu nào sau đây là đúng về xúc tác?
Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Điều chế NH3 từ N2 (g) và H2 (g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Biết khi sử dụng 14 g khí N2 sinh ra 45,9 kJ nhiệt. Phương trình nhiệt hóa học của phản ứng tạo thành NH3 là
Phương trình hóa học: N2(g) + 3H2(g) 2NH3(g)
Theo đề bài khi sử dụng 14 g khí N2 tức 0,5 mol khí N2 sinh ra 45,9 kJ nhiệt
Khi sử dụng 1 mol khí N2 sinh ra 91,8 kJ nhiệt
Phương trình nhiệt hóa học của phản ứng tạo thành NH3 là
N2(g) + 3H2(g) 2NH3(g)
= −91,8kJ
Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết > 1,7 thì đó là liên kết
Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện , ta có:
0
< 0,4: Liên kết cộng hóa trị không cực
0,4
< 1,7: Liên kết cộng hóa trị có cực.
1,7: Liên kết ion
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
Trong phân tử HCl, nguyên tử Cl có độ âm điện lớn hơn H cặp electron dùng chung lệch về phía nguyên tử Cl.
Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình.
| Chất | N2O4 (g) | CO (g) | N2O (g) | CO2 (g) |
| |
9,16 | -110,50 | 82,05 | -393,50 |
Tính biến thiên enthalpy của phản ứng sau:
N2O (g) + 3CO(g) ![]() N2O(g) + 3CO2(g)
N2O(g) + 3CO2(g)
Theo công thức (2), ta có:
=
(N2O) + 3×
(CO2) –
(N2O4) – 3.
(CO)
= 82,05 + 3.(–393,50) – 9,16 – 3.(–110,50)
= –776,11 kJ
Nguyên tử X có số hiệu nguyên tử là 19. nguyên tố Y có số hiệu nguyên tử là 9. Liên kết hóa học có thể trong phân tử của X và Y là:
Cấu hình electron của X (Z = 19): 1s22s22p63s23p64s1
X thuộc nhóm IA.
Cấu hình electron của Y (Z = 9): 1s22s22p5
Y thuộc nhóm VIIA
X là kim loại điển hình, Y là phi kim điển hình Liên kết hóa học có thể trong phân tử của X và Y là liên kết ion.
Có hai miếng iron có kích thước giống hệt nhau, một miếng là khối iron đặc (A), một miếng có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng iron vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khi hydrogen thoát ra theo thời gian. Vẽ đồ thị thể tích khi theo thời gian, thu được hai đồ thị sau:
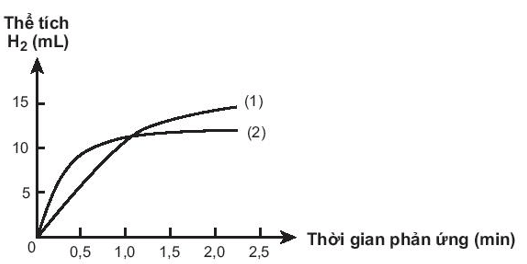
Cho các phát biểu sau, các phát biểu đúng là:
(1) Miếng iron có nhiều lỗ có diện tích bề mặt lớn hơn nên lúc đầu có tốc độ phản ứng với HCl cao hơn.
(2) Đồ thị (2) mô tả tốc độ thoát khí từ miếng iron (A).
(3) Đồ thị (1) mô tả tốc độ thoát khí từ miếng iron (B).
(4) Khi 2 miếng iron chưa phản ứng hết, thể tích khí H2 thoát ra của miếng iron (B) nhiều hơn miếng iron (A).
Các phát biểu đúng là: (1) và (4).
Miếng iron có nhiều lỗ có diện tích bề mặt lớn hơn nên lúc đầu tốc độ phản ứng với HCl cao hơn. Đồ thị (2) mô tả tốc độ thoát khí từ miếng iron B. Đồ thị (1) mô tả tốc độ thoát khí từ miếng iron A.
Số oxi hóa của bromine trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là:
Áp dụng các quy tắc xác định số oxi hóa ta có:
Hỗn hợp ammonium perchlorate (NH4CIO4) và bột nhôm là nhiên liệu rắn của tàu vũ trụ con thoi theo phản ứng sau:
NH4CIO4 → N2↑ + Cl2↑ + O2↑ + H2O
Mỗi một lần phóng tàu con thoi tiêu tốn 750 tấn ammonium perchlorate. Giả sử tất cả oxygen sinh ra tác dụng với bột nhôm, hãy tính khối lượng nhôm phản ứng với oxygen và khối lượng aluminium oxide sinh ra.
MNH4ClO4 = 117,5 amu
2NH4CIO4 → N2↑ + Cl2↑ + 2O2↑ + 4H2O (1)
3O2 + 4Al → 2Al2O3 (2)
Theo PTHH:
Khối lượng aluminum phản ứng:
Khối lượng aluminum oxide sinh ra:
Cho hai quá trình sau: ![]()
![]()
Hãy cho biết kết luận nào sau đây đúng?
Ở quá trình (1) Mg nhận electron quá trình khử
Ở quá trình (2) O nhường electron quá trình oxi hóa
Magnesium là nguyên tố có khối lượng riêng nhỏ hơn một phần ba so với aluminium. Magnesium giúp cải thiện các đặc tính cơ học của aluminium khi được sử dụng làm chất tạo hợp kim. Những hợp kim này rất hữu ích trong chế tạo máy bay và ô tô. Cấu hình electron của magnesium là 1s22s22p63s2. Công thức hydroxide của magnesium là
Cấu hình electron của magnesium là 1s22s22p63s2. Vậy magnesium thuộc nhóm IIA.
Hóa trị cao nhất của magnesium là II. Công thức hydroxide của magnesium là Mg(OH)2.
Trong bảng tuần hoàn, nguyên tố Z nằm ở chu kì 4, nhóm VB. Số hiệu nguyên tử của Z là
Cấu hình electron của Z: 1s22s22p63s23p63d34s2
Z = p = 23
Hệ số nhiệt độ của một phản ứng là 4. Ở toC tốc độ của phản ứng đo được là 5.10-3 mol.L-1.s-1; còn ở 150oC tốc độ của phản ứng đo được là 3,215.10-4 mol.L-1.s-1. Giá trị của t là
Ta có biểu thức:
Cho các phát biểu sau:
(a) Bảng tuần hoàn có 7 chu kì, trong đó có 3 chu kì nhỏ và 4 chu kì lớn.
(b) Bảng tuần hoàn có 8 nhóm, số thứ tự của nhóm bằng số electron lớp ngoài cùng.
(c) Nguyên tử các nguyên tố nhóm A có số electron lớp ngoài cùng bằng số thứ tự của nhóm.
(d) Các nguyên tố s và p thuộc về các nhóm A.
(e) Các chu kì nhỏ bao gồm các nguyên tố s, p.
Số phát biểu đúng là
Các phát biểu đúng là (a), (c), (d), (e)
Phát biểu (b) sai là do trong bảng tuần hoàn có 8 nhóm A và 8 nhóm B, số thứ tự của nhóm bằng số electron hóa trị.
Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
Nguyên tố có độ âm điện lớn nhất là F (Z = 9), có cấu hình electron: 1s22s22p5.
Muối X được tạo thành bởi một kim loại hóa trị II và phi kim hóa trị I. Hòa tan 4,44 gam X vào H2O rồi chia làm hai phần bằng nhau
- Cho phần một tác dụng với dung dịch AgNO3 dư thu được 5,74 gam kết tủa.
- Cho phần hai tác dụng với dung dịch Na2CO3 dư thu được 2 gam kết tủa.
Liên kết trong X là liên kết
Gọi kim loại A, phi kim B ⇒ Muối X là AB2
Khối lượng AB2 trong mỗi phần là: 4,44 : 2 = 2,22 g
AB2 + 2AgNO3 → 2AgB + A(NO3)2
AB2 + Na2CO3 → ACO3 + 2NaB
Từ (1) và (2) ⇒ A = 40 (Ca); B = 35,5 (Cl)
Ca là một kim loại điển hình, Cl là một phi kim điển hình nên liên kết của X là liên kết ion.
Nguyên tố Y là nguyên tố thuộc chu kì 3, có công thức oxide cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, hợp chất MY làm bề mặt lòng đỏ trứng có thể chuyển sang màu xanh lá cây khi được nấu chín trong một thời gian dài ở những quả trứng cũ, trong đó M chiếm 63,64% về khối lượng. Kim loại M là:
Y công thức Oxide cao nhất là YO3 ⇒ Y có hóa trị VI
⇒ Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 ⇒ Y là S ⇒ Hợp chất M là MS
M chiếm 63,64% khối lượng:
Vậy M là Fe.
Thuốc thử nào sau đây phân biệt được hai dung dịch HCl và NaCl?
Dung dịch HCl làm quỳ tím hóa đỏ. Dung dịch NaCl không làm quỳ tím đổi màu.
Ở một lò nung vôi công nghiệp, cứ sản xuất được 1000 kg vôi sống cần dùng m kg than đá (chứa 80% carbon) làm nhiên liệu cung cấp nhiệt.
Cho các phản ứng:
C(s) + O2(g) ![]() CO2 (g)
CO2 (g) ![]() = -393,5 kJ/mol
= -393,5 kJ/mol
CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g) ![]() = 178,29 kJ/mol
= 178,29 kJ/mol
Biết hiệu suất hấp thụ năng lượng ở quá trình phân hủy đá vôi là 60%. Giá trị của m là
1000 kg = 1000000g
Để tạo ra 1 mol CaO cần lượng nhiệt là 178,29 kJ.
⇒ Tạo ra mol CaO cần lượng nhiệt là:
Vì hiệu suất phản ứng là 60% nên:
⇒ Nhiệt lượng thực tế là:
⇒ Đốt cháy 1 mol C toả ra nhiệt lượng là 393,5kJ
Để toả ra nhiệt lượng là 5306250kJ cần số mol C là:
⇒ mC = 13484,75222.12 = 161817,0267 (g) 161,82 (kg)
Áp suất đối với chất khí ở điều kiện chuẩn là:
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Cho các phản ứng dưới đây:
(1) Cracking alkane.
(2) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
(3) Phản ứng oxi hóa.
(4) Phản ứng nhiệt nhôm.
(5) Phản ứng trung hòa.
Phản ứng nào tỏa nhiệt?
Các phản ứng tỏa nhiệt là: phản ứng oxi hóa, phản ứng nhiệt nhôm, phản ứng trung hòa.
Để hòa tan hoàn toàn 6,4 gam hỗn hợp kim loại R (chỉ có hóa trị II) và oxide của nó cần vừa đủ 400 ml dung dịch HCl 1M. Tìm kim loại R.
R + 2HCl → RCl2 + H2
RO + 2HCl → RCl2 + H2O
Ta có:
nHCl = 0,4.1 = 0,4 mol n(R,RO) = 0,2 mol
Theo tính chất của ta có:
M < 32 < M + 16 16 < M < 32
M = 24 (Mg) là nghiệm hợp lí.
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Trong phân tử KCl nguyên tử potassium nhường hay nhận bao nhiêu electron?
Khi hình thành liên kết hóa học trong phân tử KCl, nguyên tử K có 1 electron hóa trị, nguyên tử Cl có 7 electron hóa trị, nguyên tử K nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử Cl nhận 1 electron tạo thành hạt mang điện tích âm.
K → K+ +1e
Cl + 1e → Cl-
