Ammonia và một số hợp chất ammonium
I. Cấu tạo phân tử của ammonia
Trình bày cấu tạo phân tử ammonia
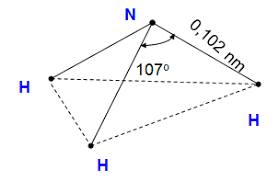
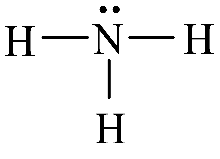
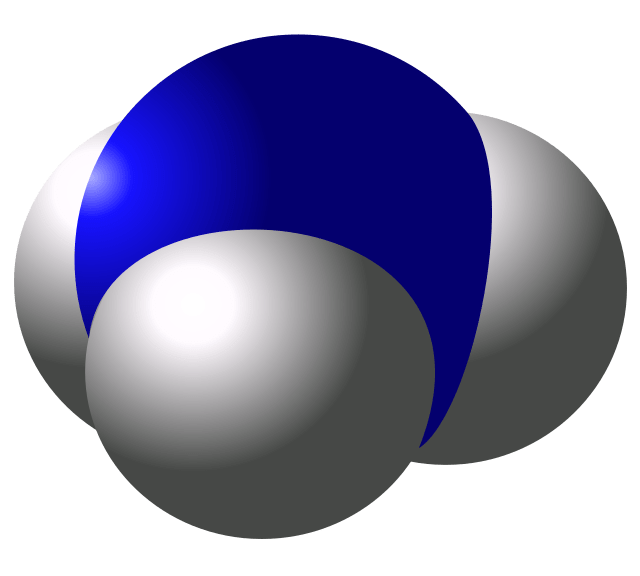
a) b) c)
Cấu tạo phân tử ammonia a), công thức Lewis của phân tử ammonia b) và mô hình phân tử ammonia c)
Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
II. Tính chất của ammonia
1. Tìm hiểu tính chất vật lí của ammonia

Thí nghiệm về tính tan của NH3 trong nước
- Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí.
- Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia.
2. Tìm hiểu tính chất hóa học của ammonia
- Khi hòa tan ammonia vào nước:
NH3 + H2O ⇌ NH4+ + OH-
- Ammonia (dạng khí cũng như dung dịch) tác dụng với acid tạo thành muối ammonium.
 NH3 tác dụng với HCl
NH3 tác dụng với HCl- Ammonia cháy trong oxygen tạo ra khí nitrogen và hơi nước.
4NH3 + 3O2 ![]() 2N2 + 6H2O
2N2 + 6H2O
- Oxi hóa ammonia bằng oxygen ở nhiệt độ cao, xúc tác Pt tạo thành NO và H2O
4NH3 + 5O2 ![]() + 4NO + 6H2O
+ 4NO + 6H2O
Ammonia chủ yếu thể hiện tính khử và tính base trong các phản ứng hóa học.
III. Tổng hợp Ammonia
Vận dụng kiến thức hóa học cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber
Các bước thực hiện của quá trình Haber:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1:3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh. Ở đây NH3 được hóa lỏng và được tách riêng, còn hỗn hợp khí N2 và H2 chưa phản ứng được đưa trở lại tháp tổng hợp.
- Phản ứng tổng hợp:
N2(g) + 3H2(g) ⇌ 2NH3(g) ![]() = -92 kJ
= -92 kJ
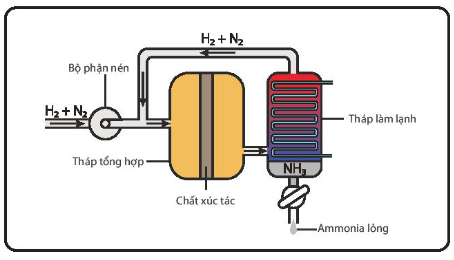 Sơ đồ thiết bị tổng hợp ammonia trong công nghiệp theo quá trình Haber
Sơ đồ thiết bị tổng hợp ammonia trong công nghiệp theo quá trình Haber
IV. Muối ammonium
1. Tìm hiểu tính chất vật lí của ammonium
- Muối ammonium đều được tạo bởi cation ammonium (NH4+) và gốc acid.
Ví dụ: ammonium chloride (NH4Cl), ammonium sulfate ((NH4)2SO4), ...
- Muối ammonium là những chất tinh thể ion. Hầu hết các muối ammonium dễ tan trong nước.
 Muối ammoni sulfate
Muối ammoni sulfate
2. Tìm hiểu tính chất hóa học của ammonium
- Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khí ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
NH4+ + OH- → NH3↑ + H2O
Ví dụ:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
- Muối ammonium dễ bị phân huỷ khi đun nóng.
Ví dụ:
NH4HCO3 ![]() NH3 + CO2 + HCl
NH3 + CO2 + HCl
NH4NO3 ![]() N2O + 2H2O
N2O + 2H2O
V. Ứng dụng
1. Tìm hiểu ứng dụng của ammonia
Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng khác trong đời sống.
 |
 |
 |
| Dùng trong hệ thống làm lạnh trong công nghiệp | Dùng để sản xuất phân bón urea | Dùng để sản xuất nitric acid |
| Một số ứng dụng của ammonia | ||
2. Tìm hiểu ứng dụng của muối ammonium
- Ammonium nitrate (NH4NO3) được dùng làm phân bón bổ sung hàm lượng nitrogen cho cây
- Ammonium chloride (NH4Cl) và ammonium sufate (NH4SO4) dùng làm phân đạm, phân bón, phức hợp,...
 |
 |
| Phân bón ammoni nitrate | Phân DAP (diammonium phosphate) |
| Một số loại phân bón ammonium |
|
Nội dung cùng chủ đề
-
Đề thi Hóa học 11 CTST
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen và sulfur
-
Chương 3: Đại cương hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl (Aldehyde - Ketone) - Carboxylic acid







