Carboxylic acid
I. Khái niệm, danh pháp
1. Khái niệm
 |
 |
 |
 |
| HCOOH | CH3COOH |
(COOH)2 |
CH3CH2CH2COOH |
| Formic acid (có trong nọc kiến) | acetic acid (có trong giấm) | Oxalic acid (có trong quả khế) | butyric acid (có trong bơ) |
Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm carboxyl (−COOH) liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc – COOH) hoặc nguyên tử hydrogen.
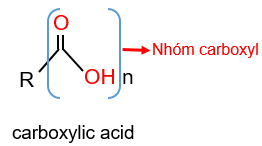
Công thức của các carboxylic acid đơn chức thường được viết ở dạng thu gọn là RCOOH.
Ví dụ:
CH3COOH, CH2 = CHCOOH, C6H5OH.
2. Danh pháp
2.1. Danh pháp thay thế
Tên theo danh pháp thay thế của carboxylic acid đơn chức:

Ví dụ:
| HCOOH | CH3CH2CH2COOH | CH2=CHCOOH |
| methanoic acid | butanoic acid | propenoic acid |
Chú ý:
Mạch chính là mạch carbon dài nhất chứa nhóm – COOH và được đánh số bắt đầu từ nhóm – COOH.
Nếu mạch carbon có nhánh thì cần thêm vị trí và tên nhánh ở phía trước.
Ví dụ:
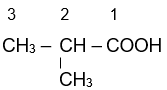 |
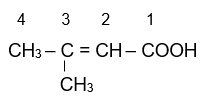 |
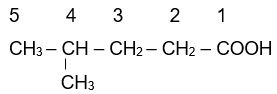 |
| 2-methylpropanoic acid | 3-methylbut-enoic acid | 4-methylpentanoic acid |
2.1. Tên thông thường
Tên thông thường của carboxylic acid thường xuất phát từ nguồn gốc tìm ra chúng trong tự nhiên.
Ví dụ:
| Công thức cấu tạo | Tên theo danh pháp thay thế | Tên thông thường | Nguồn gốc |
| HCOOH | methanoic acid | formic acid | formica |
| CH3COOH | ethanoic acid | acetic acid | acetum |
| CH3CH2COOH | propanoic acid | propionic acid | propion |
| CH3[CH2]14COOH | hexadecanoic acid | pamitic acid | palma |
| CH3[CH2]16COOH | octadecanoic acid | stearic acid | stear |
| C6H5COOH | phenylmethanoic acid | benzoic acid | benzoin |
| HOOC-COOH | ethanedioic acid | oxalic acid | oxalis |
II. Đặc điểm cấu tạo
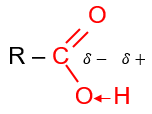
Nhóm carboxyl gồm có nhóm hydroxyl ( –O–H) liên kết với nhóm carbonyl (>C=O).
Nhóm >C=O là nhóm hút electron nên liên kết O – H trong carboxylic phân cực hơn so với alcohol, phenol. Nhóm –COOH có thể phân li ra H+ nên tính chất hoá học đặc trưng của carboxylic acid là tính acid.
 |
|
| Cấu tạo nhóm carboxyl | Mô hình phân tử acetic acid |
III. Tính chất vật lí
Phân tử carboxylic acid chứa nhóm carboxyl phân cực. Các phân tử carboxyl acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử:
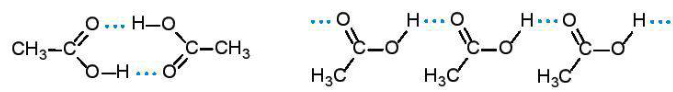
| Dạng dimer | Dạng liên phân tử |
Do vậy, carboxylic acid có nhiệt độ sôi cao hơn so với hydrocarbon, alcohol, hợp chất carbonyl có phân tử khối tương đương.
Carboxylic acid mạch ngắn là chất lỏng ở nhiệt độ phòng, carboxylic acid dạng dài là chất rắn dạng sáp. Carboxylic acid thường có mùi chua nồng.
Carboxylic acid mạch ngắn tan tốt trong nước. Khi tăng số nguyên tử carbon trong gốc hydrocarbon thì độ tan của carboxylic acid giảm.
IV. Tính chất hoá học
1. Tính acid
Trong dung dịch nước, chỉ một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid.
Ví dụ:
2CH3COOH + Zn → (CH3COO)2Zn + H2
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
2. Phản ứng ester hoá
Carboxylic acid phản ứng với alcohol tạo thành ester và nước theo phản ứng:
Phản ứng giữa carboxylic acid và alcohol được gọi là phản ứng ester hoá. Phản ứng có đặc điểm là thuận nghịch và thường dùng sulfuric acid đặc làm xúc tác.
RCOOH + R'OH ![]() RCOOR' + H2O
RCOOR' + H2O
Ví dụ:
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
V. Điều chế
1. Phương pháp lên men giấm
Phương pháp lên men được sử dụng từ thời xa xưa để làm giấm. Nguyên liệu thường dùng là các loại rượu như rượu gạo, rượu táo, rượu vang, … Quá trình lên men nhờ vi khuẩn acetobacter (men giấm) chuyển hoá ethanol thành acetic acid bởi oxygen trong không khí.
C2H5OH + O2 ![]() CH3COOH + H2O
CH3COOH + H2O
Trong công nghiệp, người ta cung cấp thêm oxygen để tăng tốc độ lên men.
2. Phương pháp oxi hoá alkane
Các alkane bị oxi hoá cắt mạch tạo thành các acid:
R–CH2–CH2–R’ ![]() RCOOH + R’COOH
RCOOH + R’COOH
Ví dụ:
2CH3CH2CH2CH3 + 5O2 ![]() 4CH3COOH + 2H2O
4CH3COOH + 2H2O
VI. Ứng dụng
Một số ứng dụng của carboxylic acid được thể hiện trong sơ đồ sau:
Nội dung cùng chủ đề
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen - Sulfur
-
Chương 3: Đại cương về hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl - Carboxylic acid
-
Đề thi Hóa 11 KNTT







