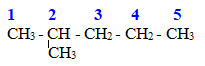Cho 7,2 gam alkane X tác dụng với clo theo tỉ lệ mol 1:1 tạo ra 10,65 gam dẫn xuất monochlorine duy nhất. Công thức cấu tạo thu gọn của X là
Ta có phương trình tổng quát phản ứng:
CnH2n+2 + Cl2 → CnH2n+1Cl + HCl
14n+2 14n+36,5 (gam)
7,2 10,65 (gam)
Theo phương trình phản ứng tổng quát ta có:
10,65.(14n+2) = 7,2.(14n+36,5)
48,3n = 241,5 ⇒ n = 5
Công thức phân tử của X là C5H12
Vì alkane X tác dụng với clo theo tỉ lệ mol 1:1 tạo ra dẫn xuất monochlorine duy nhất
Công thức cấu tạo thu gọn của X thỏa mãn là (CH3)4C.