Nitrogen
I. Trạng thái tự nhiên
Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75,5% khối lượng (hoặc 78,1% thể tích ) và tập trung chủ yếu ở tầng đối lưu.

Trong vỏ Trái Đất thì nó tồn tại tập trung ở một số mỏ khoáng dưới dạng sodium nitrate (thường gọi là diêm tiêu Chile).
Nguyên tố nitrogen có trong tất cả cơ thể động vật và thực vật và trong cả cơ thể người.
Nguyên tố nitrogen tồn tại trong tự nhiên với hai đồng vị bền là 14N (99,63%) và 15N (0,37%).
II. Cấu tạo nguyên tử, phân tử
1. Cấu tạo nguyên tử
|
Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn. Nguyên tử nitrogen có độ âm điện lớn (3,04). Nitrogen là phi kim điển hình. |
 |
Nitrogen tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ -3 đến +5.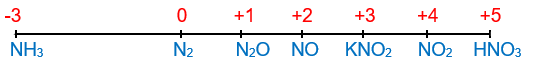
2. Cấu tạo phân tử
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết σ và 2 liên kết π). Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
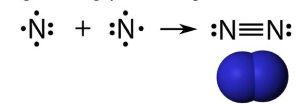
III. Tính chất vật lí
Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hoá lỏng (hoá lỏng ở –196oC), tan rất ít trong nước (1 lít nước hoà tan được 0,012 lit khí nitrogen). Khi nitrogen không duy trì sự chảy và sự hô hấp.
IV. Tính chất hoá học
Nitrogen khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động hơn. Nitrogen thể hiện cả tính oxi hoá và tính khử.
1. Tác dụng với hydrogen
Ở nhiệt độ cao, áp suất cao và có xúc tác, nitrogen hóa hợp trực tiếp với hydrogen, tạo thành ammonia.
N2 (g) + 3H2 (g) ![]() 2NH3 (g)
2NH3 (g)
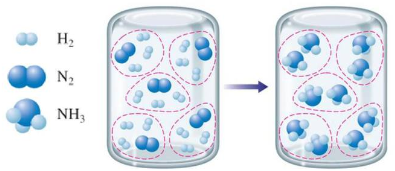
Phản ứng tổng hợp ammonia là quá trình trung gian quan trọng để sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, ammophos....
2. Tác dụng với oxygen
Ở nhiệt độ cao trên 3000oC hoặc có tia lửa điện, nitrogen kết hợp với oxygen, tạo ra nitrogen monoxide (NO)
N2(g) + O2(g) ⇌ 2NO(g) (điều kiện nhiệt độ)
Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa được biểu diễn theo sơ đồ sau:

N2 ![]() NO
NO ![]() NO2
NO2 ![]() HNO3 → H+ + NO3-
HNO3 → H+ + NO3-
Trong thực tế, phản ứng hoá hợp giữa nitrogen với oxygen thường xảy ra đồng thời với quá trình đốt cháy nhiên liệu ở nhiệt độ cao bằng không khi.
Các hoạt động giao thông vận tải và sản xuất công nghiệp là nguyên nhân chính gây phát thải các oxide của nitrogen vào khí quyển.

V. Ứng dụng
- Tác nhân làm lạnh.
- Tổng hợp ammoniac.
- Tạo khí quyển trơ.
- Bảo quản thực phẩm.
Nội dung cùng chủ đề
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen - Sulfur
-
Chương 3: Đại cương về hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl - Carboxylic acid
-
Đề thi Hóa 11 KNTT







