Ôn tập chương 1
Hệ thống hóa kiến thức
1. Cân bằng hóa học
|
Phản ứng một chiều aA + bB → cC + dD Phản ứng chỉ xảy ra một chiều từ chất đầu tạo thành sản phẩm |
Phản ứng thuận nghịch aA + bB Trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau |
| Trạng thái cân bằng | V thuận = V nghịch; nồng độ các chất trong hệ phản ứng không đổi. |
| Hằng số cân bằng |
Trong đó: [A]; [B]; [C]; [D] |
| Các yếu tố ảnh hưởng đến cân bằng hóa học | Nhiệt độ, nồng độ, áp suất |
| Nguyên lí chuyển dịch cân bằng Le Chateller | Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nhiệt độ, nồng độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm các tác động bên ngoài đó. |
Câu trắc nghiệm mã số: 42465,40738,40739,34982
2. Cân bằng trong dung dịch nước.
|
Sự điện li Quá trình phân li các chất trong nước tạo thành ion. Chất điện li mạnh: acid mạnh, base mạnh, hầu hết muối. Chất điện li yếu: acid yếu, base yếu. Chất không điện li: nước, saccharose, ethanol, ... |
Thuyết acid - base của Br∅nsted - Lowry Acid là chất cho proton Base là chất nhận proton. |
|
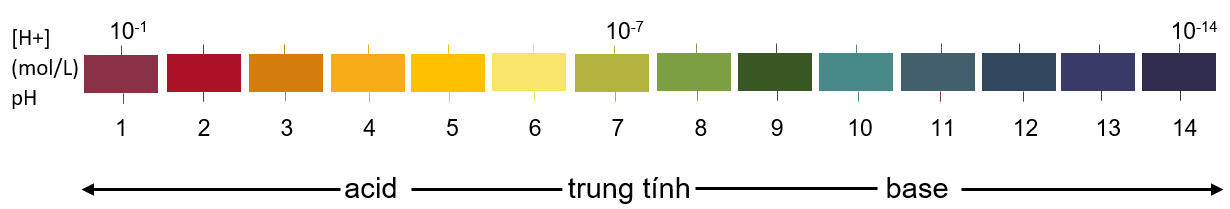
pH = -lg[H+] hoặc [H+] = 10-pH
|
|
| Trong dung dịch nước, một số ion như Al3+, Fe3+ và CO32- phản ứng với nước tạo ra cá dung dịch có môi trường acid/base. | |
Câu trắc nghiệm mã số: 43530,40912,40911,40814,40794,33455,2501,2544,2542
Nội dung cùng chủ đề
Sắp xếp theo
Xóa
Gửi bình luận
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen - Sulfur
-
Chương 3: Đại cương về hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl - Carboxylic acid
-
Đề thi Hóa 11 KNTT