Ứng với công thức phân tử C5H10O2 số đồng phân cacrboxylic acid là:
Số đồng phân acid ưng với công thức phân tử C5H10O2 là
CH3CH2CH2CH2COOH
CH3CH2CH(CH3)COOH
CH3CH(CH3)CH2COOH
CH3C(CH3)2COOH.
Ứng với công thức phân tử C5H10O2 số đồng phân cacrboxylic acid là:
Số đồng phân acid ưng với công thức phân tử C5H10O2 là
CH3CH2CH2CH2COOH
CH3CH2CH(CH3)COOH
CH3CH(CH3)CH2COOH
CH3C(CH3)2COOH.
Có thể phân biết 3 lọ mất nhãn chứa: HCOOH, CH3COOH, C2H5OH bằng hóa chất nào dưới đây?
Phân tích các đáp án:
Nếu dùng dung dịch AgNO3/NH3 chỉ phân biệt được HCOOH.
NaOH chỉ nhận biết được C2H5OH không phản ứng
Cả 3 chất đều phản ứng với Na không thể nhận biết được
Cu(OH)2/OH-
Tác dụng với với CH3COOH như bình thường còn HCOOH tạo kết tủa đỏ gạch
Không phản ứng với C2H5OH.
Một acid hữu cơ no, đơn chức, mạch hở A có công thức đơn giản nhất là CH2O. Công thức phân tử của acid hữu cơ A đó là
Công thức đơn giản nhất là (CH2O)n
Vì là acid hữu cơ no, đơn chức, mạch hở ⇒ Chỉ chứa 1 nhóm chức - COOH
Vậy n chỉ có thể là 2
⇒ Công thức phân tử của acid hữu cơ A đó là CH3COOH.
Có thể điều chế acetic acid từ hợp chất nào dưới đây:
Có thể điều chế acetic acid từ tất cả các chất trên
Phương trình phản ứng minh họa
CH3CHO + O2 CH3COOH
C2H5OH + O2 CH3COOH + H2O
CH3CCl3 + 3NaOH → CH3COOH + 3NaCl + H2O
Dãy chất phản ứng với dung dịch acetic acid à
Dãy chất ZnO, Na2CO3, Fe, KOH phản ứng được với dung dịch acetic acid
Phương trình phản ứng minh họa
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
Zn + 2CH3COOH → Zn(CH3COO)2 + H2
CH3COOH + KOH → CH3COOK + H2O
Cho 26,8 gam hỗn hợp X gồm hai acid no, đơn chức mạch hở, kế tiếp nhau trong cùng dãy đồng đẳng tác dụng với Na dư, thu được 35,6 gam muối. Khối lượng của acid có số nguyên tử carbon ít hơn trong hỗn hợp là:
Gọi công thức chung của 2 acid hữu cơ no đơn chức mạch hở là RCOOH.
Phương trình phản ứng tổng quát:
2RCOOH + 2Na → 2RCOONa + H2
Dựa vào phương trình ta có:
nRCOOH = nRCOONa
⇔
26,8.(R+67) = 35,6.(R+45)
⇒ R = 22
⇒ Hai acid no, đơn chức mạch hở, kế tiếp nhau trong dãy đồng đẳng chính là CH3COOH và C2H5COOH.
Gọi x, y lần lượt là số mol của CH3COOH và C2H5COOH
Ta có hệ phương trình:
⇒ nCH3COOH = 0,2
⇒ mCH3COOH = 0,2.60 = 12 gam
Cho 3,69 gam hỗn hợp HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 400 ml dung dịch NaOH 1,5M. Tổng khối lượng muối thu được sau phản ứng là:
Phương trình phản ứng:
HCOOH + NaOH → HCOONa + H2O
CH3COONa + NaOH → CH3COONa + H2O
C6H5OH + NaOH → C6H5ONa + H2O
Ta nhận thấy nH2O = nNaOH= 0,6 mol
Áp dụng bảo toàn khối lượng ta có:
m hỗn hợp + mNaOH = m muối + mH2O
⇒ mmuối= 3,69 + 0,6.40 – 0,6.18 = 16,89 gam.
Công thức nào dưới đây là của 2,4-đimethylpentanoic acid?
2,4-đimethylpentanoic có công thức cấu tạo hóa học là:
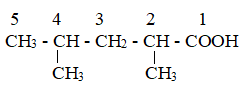
Đáp án đúng là:CH3CH(CH3)CH2CH(CH3)COOH.
Acid không no, đơn chức có một liên kết đôi trong gốc hydrocarbon có công thức phù hợp là:
Công thức đổng quát Acid là:
CnH2n+2-2k-z(COOH)z (k = số liên kết pi + số vòng)
Acid có 1 liên kết đôi trong hydrocarbon + đơn chức ⇒ k = 1, z = 1
⇒ CnH2n+2-2.1-1(COOH)1
Hay CnH2n-1COOH (n≥2).
Phân tích một dicarboxylic acid mạch phân nhánh X có thành phần các nguyên tố %C = 45,46%; %H = 6,06%, còn lại là của oxygen. Công thức cấu tạo của X là
%O = 100% - 45,46% - 6,06% = 48,49%
MX = 132 (g/mol)
Gọi công thức phân tử của X là CnHmO4:
m = 8
⇒ n = 5
Vậy công thức phân tử của X là C5H8O4
Ứng với công thức cấu tạo là: HOOCCH2CH2CH2COOH.
Để trung hòa 9,0 gam một carboxylic acid Y (no, đơn chức), cần dùng 200 gam dung dịch NaOH 3,0%. Công thức của Y là
mNaOH = 3.200:100 = 6 gam
⇒ nNaOH = 6:40 = 0,15 mol
Y là acid no, đơn chức nên có công tổng tổng quát là RCOOH
RCOOH + NaOH → RCOONa + 1/2H2
Theo phương trình phản ứng
nRCOOH = nNaOH = 0,15 mol
M = 9:0,15 = 60 gam/mol
⇒ R = 15 (CH3)
Vậy Y là CH3COOH
Cho 50 ml dung dịch (chứa 0,035 mol hỗn hợp một carboxylic acid đơn chức và muối của nó với một kim loại kiềm) tác dụng với 12 ml dung dịch Ba(OH)2 1,25M. Sau phản ứng, để trung hòa dung dịch cần thêm 3,75 gam dung dịch HCl 1,46%. Sau đó cô cạn dung dịch thì thu được 5,4325 gam muối khan. Nếu đem 50 ml dung dịch A ở trên tác dụng với 20 ml dung dịch NaOH 1M, phản ứng hoàn toàn, cô cạn dung dịch thì khối lượng chất rắn thu được là bao nhiêu?
nBa(OH)2 = 0,015 mol; nHCl = 0,015 mol
2HCl + Ba(OH)2 → BaCl2 + 2H2O
0,015 → 0,0075
nBa(OH)2 pư = 0,0075 mol
nacid = 2nBa(OH)2 = 0,015 mol
nmuối = 0,035 – 0,015 = 0,02 mol
Áp dụng định luật bảo toàn khối lượng ta có:
5,4325 = mBaCl2 + mhh ban đầu + mtăng của hỗn hợp pư với Ba(OH)2
5,4325 = 0,0075.208 + mhh ban đầu + 0,0075.(137 – 2)
mhh ban đầu = 2,86 gam
Khi tác dụng với NaOH thì khối lượng chất rắn thu được gồm NaOH dư và khối lượng muối.
Áp dụng tăng giảm khối lượng:
mrắn = 2,86 + 0,015.22 + 0,005.40 = 3,39 gam
Chất nào sau đây có nhiệt độ sôi cao nhất.
H linh động càng cao thì nhiệt độ sôi càng lớn
So sánh nhiệt độ sôi của các hợp chất hữu cơ: Carboxylic acid > alcohol > aldehyde > hydrocarbon.
CH3COOH > C2H5OH > CH3CHO > C3H8.
Vậy CH3COOH có nhiệt độ sôi cao nhất.
Đốt cháy hoàn toàn 3,12 gam carboxylic acid X thu được 3,96 gam CO2. Cũng với lượng acid trên trung hòa bởi 30 ml dung dịch NaOH 2M. Công thức phân tử của X là:
nCO2 = 3,96 : 44 = 0,09 mol
Gọi n là số C trong X
Áp dụng bảo toàn nguyên tố C ta có:
Xét các cặp giá trị thỏa mãn theo đáp án đề bài ta có
| n | 2 | 3 | 4 |
| M | 69,33 (Loại) | 104 | 138,67 (Loại) |
Vậy với M = 104 ⇒ Công thức phân tử X là C3H4O4.
Cho các chất sau: CH3COOH, C2H5OH, CO2 và C6H5OH. Thứ tự tăng dần tính acid của các chất trên là:
Tính acid thể hiện ở H linh động.
C2H5OH không phản ứng với NaOH ⇒ H linh động nhỏ nhất.
CH3COOH vừa phản ứng NaOH và Na ⇒ H linh động lớn nhất
C6H5OH phản ứng với CO2 ⇒ Tính acid của C6H5OH < CO2.
Vậy thứ tự tăng dần tính acid của các chất là: C2H5OH < C6H5OH < CO2 < CH3COOH.
