Một số hợp chất của nitrogen với oxygen
I. Các oxide của nitrogen
1. Công thức, tên gọi
Oxide của nitrogen được kí hiệu chung là: NOx.
|
Oxide |
N2O |
NO |
NO2 |
N2O4 |
|
Tên gọi |
Dinitrogen oxide |
Nitrogen monoxide |
Nitrogen dioxide |
Dinitrogen tetroxide |
2. Nguồn gốc phát sinh NOx trong không khí.
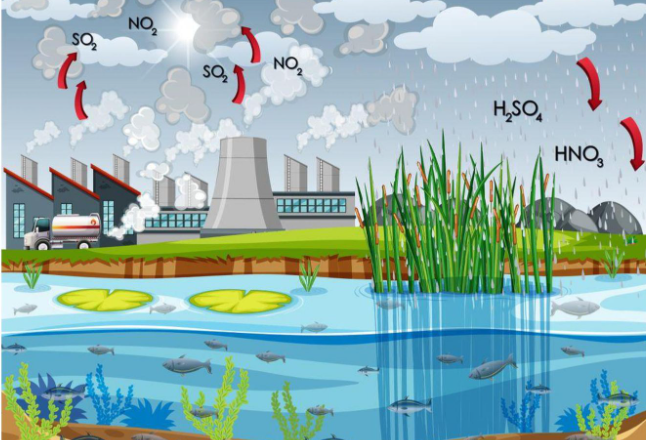
Tự nhiên: Núi lửa phun trào, cháy rừng, mưa dông kèm sấm sét.
Con người: do hoạt động của con người: giao thông vân tải, sản xuất công nghiệp, nông nghiệp…
Tác hại: Là nguyên nhân gây mưa acid, sương mù quang hóa, hiệu ứng nhà kính, thủng tầng ozon, làm ô nhiễm môi trường…
Nguyên nhân hình thành NOx trong không khí
| Loại NOx | NOx nhiệt | NOx nhiên liệu | NOx tức thời |
| Nguyên nhân tạo thành |
Nhiệt độ rất cao (trên 3000oC) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: N2 + O2 |
Nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen trong không khí. | Nitrogen trong không khí tác dụng với các gốc tự do gốc hydrocarbon, gốc hydroxyl, ...) |
3. Mưa acid
Mưa acid là hiện tượng nước mưa có pH < 5,6.
Tác nhân chính gây mưa acid SO2 và NOx, phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ, ...
Ví dụ:
2SO2 + O2 + 2H2O ![]() 2H2SO4
2H2SO4
4NO2 + O2 + 2H2O ![]() 4HNO3
4HNO3
Tác hại: Gây ảnh hướng xấu đến môi trường, con người và sinh vật như: ăn mòn các công trình xây dựng, kiến trúc bằng đá và kim loại, …
II. Nitric acid
1. Cấu tạo
- Nguyên tử N có số oxi hóa +5, số oxi hóa cao nhất của nitrogen.
- Liên kết O-H phân cực mạnh về phía nguyên tử oxygen.
- Liên kết N → O là liên kết cho nhận
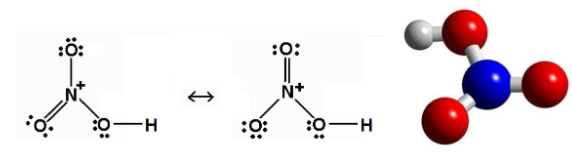
Công thức Lewis và mô hình cấu tạo phân tử Nitric acid
2. Tính chất vật lí
Nitric acid tinh khiết là chất lỏng, không màu, có khối lượng riêng D = 1,53 g/ml.
Nitric acid bốc khói mạnh trong không khí ẩm và tan vô hạn trong nước.
3. Tính chất hóa học
3.1. Tính acid
Thể hiện tính chất hóa học của một acid.
+ Làm quỳ tím đổi màu thành đỏ.
+ Tác dụng với base.
+ Tác dụng với oxide base.
+ Tác dụng với muối
Trong công nghiệp, sản xuất phân bón giàu dinh dưỡng như ammonium nitrat, calcium nitrate.
NH3 + HNO3 → NH4NO3
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
3.2. Tính oxi hóa
Acid nitric có tính oxi hóa mạnh.
a) Với kim loại: HNO3 oxi hóa hầu hết các kim loại (trừ Au và Pt).
Với những kim loại có tính khử yếu: Cu, Ag, ...
3Cu + 8HNO3(loãng) → 3Cu(NO3)2 + 2NO + 4H2O
Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ...
+ HNO3 đặc bị khử đến NO2.
Ví dụ:
Mg + 4HNO3(đặc) → Mg(NO3)2 + 2NO2 + 2H2O.
+ HNO3 loãng bị khử đến N2O hoặc N2.
8Al + 30HNO3 (loãng) → 8Al(NO3)3 + 3N2O + 15H2O
+ HNO3 rất loãng bị khử đến NH3(NH4NO3).
4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
Chú ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội.
b) Với phi kim
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S, …(trừ N2 và halogen).
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
c) Với hợp chất
H2S, HI, SO2, FeO, muối iron (II), … có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(đặc) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(đặc) → 3S + 2NO + 4H2O
III. Hiện tượng phú dưỡng
Nguyên nhân: Do sự dư thừa dinh dưỡng đã cung cấp nguồn thức ăn dồi dào cho sinh vật phù du phát triển rất mạnh.
Tác hại: Gây cản trở sự hấp thụ ánh sáng mặt trời vào nước, làm giảm sự quang hợp của thực vật thủy sinh; tạo ra sự dư thừa dinh dưỡng.
 |
 |
Hạn chế: Lưu thông nước, xử lý nước thải và sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm.
Nội dung cùng chủ đề
-
Chương 1: Cân bằng hóa học
-
Chương 2: Nitrogen - Sulfur
-
Chương 3: Đại cương về hóa học hữu cơ
-
Chương 4: Hydrocarbon
-
Chương 5: Dẫn xuất halogen - Alcohol - Phenol
-
Chương 6: Hợp chất carbonyl - Carboxylic acid
-
Đề thi Hóa 11 KNTT







