Khái niệm về cân bằng hóa học
I. Phản ứng một chiều và phản ứng thuận nghịch
1. Phản ứng một chiều
Phản ứng một chiều là phản ứng xảy ra theo một chiều trong cùng điều kiện.
Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên chỉ chiều phản ứng. Kí hiệu mũi tên (→) để chỉ chiều phản ứng.
Ví dụ: Phương trình phản ứng hóa học của một số phản ứng
NaOH + HCl → NaCl + H2O
NH3 + HCl → NH4Cl
Fe + H2SO4 → FeSO4 + H2
2. Phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau (⇌). Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Ví dụ:
Cl2 (g) + H2O (l) ⇌ HCl (aq) + HClO (aq) (1)
Ở điều kiện thường, Cl2 phản ứng với nước tạo thành HCl và HClO, từ đó thể hiện được tính tẩy màu của chlorine ẩm.
![]()
Đồng thời trong cùng điều kiện này, HCl và HClO sinh ra cũng tác dụng được với nhau tạo thành Cl2 và nước.
![]()
Do vậy, phản ứng (1) dùng (⇌) thay vì (→) trong phương trình.
Ví dụ:
Than cháy trong điều kiện thiếu không khí
C + CO2 ⇌ 2CO

II. Cân bằng hóa học
1. Trạng thái cân bằng
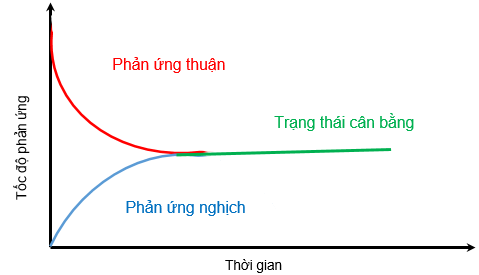 Đồ thị biểu diễn tốc độ phản ứng thuận và tốc độ phản ứng nghịch theo thời gian
Đồ thị biểu diễn tốc độ phản ứng thuận và tốc độ phản ứng nghịch theo thời gian
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Ví dụ:
N2 (g) + H2 (g) ![]() NH3 (g)
NH3 (g)
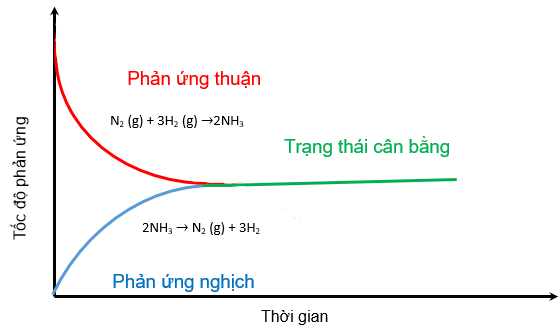
Ban đầu tốc độ phản ứng thuận có tốc độ lớn hơn phản ứng nghịch và ưu tiên tạo ra ammonia.
Theo thời gian, tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghich tăng dần đến tốc độ hai phản ứng bằng nhau.
Tại thời điểm này, số mol của các chất nitrogen, hydrogen, ammonia không thay đổi nữa. Đây là thời điểm phản ứng thuận nghịch đạt trạng thái cân bằng.
Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau để tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cần bằng, nồng độ các chất không thay đổi.
2. Hằng số cân bằng
2.1. Biểu thức của hằng số cân bằng
Với một phản ứng thuận nghịch bất kì, chẳng hạn:
aA + bB ⇌ cC + dD
Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định theo biểu thức:
![]()
Trong đó:
[A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng.
Chú ý:
Chất rắn không xuất hiện trong biểu thức tính KC
KC chỉ phụ thuộc nhiệt độ.
Ví dụ:
C (s) + CO2 (g) ⇌ 2CO
![]()
2.2. Ý nghĩa của hằng số cân bằng
Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
Biểu thức xác định hằng số cân bằng ![]() Ta có thể thấy rằng:
Ta có thể thấy rằng:
+ KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại.
+ KC càng nhỏ thi phản ứng nghịch càng chiếm ưu thế hơn.
III. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
1. Ảnh hưởng của nhiệt độ
1.1. Ví dụ
2NO2 (g) ⇌ N2O4 (g)
(màu nâu đỏ) không màu
Ống nghiệm (1) được để ở nhiệt độ phòng
Ống nghiệm (2) được để ở cốc nước đá.
Ống nghiệm (3) được để ở cốc nước nóng.

Ống nghiệm 3 đậm màu hơn ống nghiệm 1.
Ống nghiệm 2 nhạt màu hơn ống nghiệm 1.
⇒ Cân bằng bị phá vỡ khi thay đổi nhiệt độ.
Ống nghiệm 3 cân bằng chuyển dịch theo chiều nghịch.
Ống nghiệm 2 cân bằng chuyển dịch theo chiều thuận.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phân ứng thu nhiệt ( ΔrHo298 > 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
1.2. Bài tập luyện tập
Xét phản ứng trong thí nghiệm (1) như sau:
2NO2 (g) ⇌ N2O4 (g) ( ΔrHo298 = -58kJ)

Cho biết:
a) Chiều nào của phản ứng là chiều thu nhiệt và chiều nào là chiều tỏa nhiệt?
b) Khi làm lạnh bình (3) và nóng bình (2) thì cân bằng trong mỗi bình chuyển dịch theo chiều tỏa nhiệt hay thu nhiệt.
Hướng dẫn trả lời
a)
Phản ứng thuận tỏa nhiệt vì ΔrHo298 = -58kJ < 0
Phản ứng nghịch thu nhiệt vì ΔrHo298 =+58kJ > 0
b) Khi làm lạnh bình (3) cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt (giảm tác động giảm nhiệt độ)
Khi làm nóng bình (2) cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (giảm tác động tăng nhiệt độ)
2. Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
Ví dụ:
Xét hệ cân bằng sau:
C (s) + CO2 (g) ⇌ 2CO
Thổi thêm khí CO2 vào thì nồng độ CO2 tăng lên, làm cân bằng thay đổi. Khi đó cân bằng sẽ chuyển dịch theo chiều làm giả tác động này, tức là theo chiều làm giảm nồng độ CO2 (chiều thuận)
Chú ý:
Nếu trong hệ có chất rắn thì việc thêm hay bớt một lượng chất rắn hầu như không làm chuyển dịch cân bằng.
Ví dụ:
Hãy cho biết cân bằng sau chuyển dịch theo chiều nào khi thêm một lượng khí CO vào hệ cân bằng dưới đây:
C (s) + CO2 (g) ⇌ 2CO
Trả lời:
Cân bằng chuyển dịch theo chiều nghịch khi thêm một lượng khí CO vào hệ cân bằng.
3. Nguyên lý chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng.







